| chimica |
|
APPUNTI DI CHIMICA PER LE PROFESSIONI SANITARIE
La Chimica
La Chimica studia la struttura, la composizione le proprietà della materia, le sue trasformazioni e le leggi che le governano.
La Chimica si divide in:
chimica generale: studia la struttura dell'atomo e del legame chimico;
chimica inorganica: studia sistematicamente tutti gli elementi chimici;
chimica organica: è la chimica dei derivati del carbonio;
chimica analitica: studia i metodi per individuare i singoli componenti di una miscela o di un composto e per determinarne le relative quantità;
chimica-fisica: studia da un punto di vista fisico alcuni aspetti della chimica generale quali la atomistica, termochimica, radioattività . .
La materia
La materia: tutto ciò che ha massa e dimensioni (discontinuità nello spazio) ed è soggetto alla forza di gravità. E' energia in forma di riposo.
La massa di un frammento di materia rappresenta una misura della sua inerzia, cioè della sua resistenza a essere messo in moto se è fermo, o ad essere arrestato se è in moto.
Struttura della materia
sostanza pura: qualità di materia composta da molecole tutte uguali tra loro (es. H2O)
elemento: sostanza pura composta da molecole contenenti atomi tutti uguali tra loro (es. O2)
molecola: la più piccola parte di sostanza pura che conserva ancora tutte le proprietà chimiche della sostanza stessa
atomo: chimicamente indivisibile; costituente della molecola; è la più piccola particella ancora suscettibile di trasformazioni chimiche che si può ottenere per mezzo di processi chimici.
Materia e energia
Energia è capacità di produrre lavoro. La materia deve essere considerata come uno stato di riposo dell'energia: materia e energia sono quindi aspetti diversi di una stessa entità fisica.
Ogni sistema materiale in equilibrio instabile ha la possibilità teorica di trasformare in energia una parte della sua massa, secondo l'equazione:
DE = Dmc2
e di raggiungere così un equilibrio più stabile, corrispondente ad un minore contenuto energetico.
Ogni sistema materiale tende infatti ad un contenuto minimo di energia potenziale. Una reazione tra A e B accade perché A e B portano energia al sistema, energia che deve essere liberata perché il sistema divenga stabile (= a minimo contenuto energetico potenziale): A + B C + D + energia
Nelle comuni reazioni chimiche, l'energia che si sviluppa corrisponde a differenze di massa estremamente piccole, tanto da essere in pratica trascurabili: è sempre però rigorosamente valida la legge della conservazione della massa-energia.
Struttura dell'atomo.
L'atomo è la più piccola particella di materia che si possa ottenere per mezzo di un processo chimico (chimicamente indivisibile). Le particelle che lo compongono, se isolate, non hanno la possibilità di esistenza indipendente.
Al centro dell'atomo c'è il nucleo (109 volte più piccolo del diametro dell'atomo!). Il nucleo è formato da due tipi di particelle (nucleoni): i protoni (carica positiva) ed i neutroni (nessuna carica). Queste particelle, che immaginiamo sferiche, hanno massa di circa 1 uma (unità di massa atomica, è la massa dell'atomo di idrogeno).
Attorno al nucleo ruotano, a grandissima distanza e velocità (circa 1/100 della velocità della luce), gli elettroni: piccole particelle aventi carica negativa e massa 1837 volte più piccola dei nucleoni. Nell'insieme, l'atomo è elettricamente neutro.
Il volume dell'atomo corrisponde di fatto allo spazio in cui ruotano gli elettroni: il suo diametro è dell'ordine degli Angstrom (1 Å = 10-7 mm). Il diametro del nucleo è invece molto più piccolo del diametro dell'atomo: circa 10.000 volte inferiore. Ciò significa che l'atomo è per la maggior parte spazio vuoto! Tutta la massa dell'atomo è praticamente situata nel nucleo (essendo la massa degli elettroni trascurabile rispetto a quella dei nucleoni): la densità del nucleo è di 106 ton/cm3 !
La massa degli atomi dei vari elementi è compresa tra 10-24 e 10-22 g: per evitare numeri così piccoli, la massa dell'atomo si misura in unità di massa atomica (uma): 1 uma è per convenzione la dodicesima parte della massa del carbonio 12 (l'isotopo più comune del carbonio).
1 uma = 1.66 x 10-24 g
Massa protone: 1.00757 uma (circa 1)
Massa neutrone: 1.00893 uma (circa 1)
Massa elettrone: 0.000548 uma(circa zero)
La somma delle masse di protoni e neutroni dà la massa atomica.
Esempi: idrogeno 1 uma; carbonio 12 uma; ossigeno 16 uma; sodio 23 uma; cloro 35 uma.
La somma delle masse atomiche dei vari atomi in una molecola dà la massa molecolare.
Esempi: H2O 18 uma; NaCl 58 uma.
Il grammo-atomo è il peso atomico espresso in g (12g per il carbonio); la grammo-molecola è il peso molecolare espresso in g (18g per l'acqua). In un grammo-atomo e in una grammo-molecola è contenuto lo stesso numero di atomi o di molecole: il numero di Avogadro o mole.
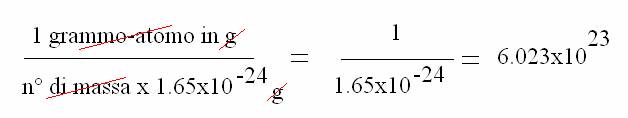
media
peso protoni e neutroni
Per qualunque elemento, in un grammo atomo è sempre contenuto lo stesso numero di atomi, cioè una mole (N).
Per qualunque molecola, in un grammo-molecola è sempre contenuto lo stesso numero di molecole, cioè una mole.
1 particella (atomo/molecola) suo peso in uma stesso peso in g N particelle
Mole = peso atomico o molecolare espresso in g; contiene 6.023x1023 atomi/molecole
Nel nucleo esiste una repulsione elettrostatica tra i protoni: questi tuttavia rimangono legati tra loro e con i neutroni grazie alla presenza di una particella elementare (mesone p o pione) condivisa tra due particelle più grandi in modo da costituire un legame tra loro (forze di scambio). Il campo elettrico positivo del nucleo trattiene gli elettroni in orbita intorno ad esso.
La differenza tra atomi diversi sta nel diverso numero di protoni (e quindi di elettroni) e di neutroni.
Z = numero di elettroni (e quindi di protoni) NUMERO ATOMICO
A = protoni + neutroni NUMERO DI MASSA
A - Z = numero di neutroni
M = peso atomico o MASSA ATOMICA (in uma)
La massa atomica non coincide col numero atomico per varie ragioni:
le masse di protoni e neutroni non sono proprio uguali a 1
in uno stesso elemento spesso ci sono isotopi diversi (diverso numero di neutroni, vedi sotto), che contribuiscono ognuno per una certa percentuale al peso atomico medio finale
se si potesse pesare, un nucleo peserebbe meno della somma dei pesi dei protoni e neutroni che contiene: all'atto della sua formazione, si libera una grande quantità di energia (energia di legame nucleare), che comporta una perdita di massa (difetto di massa). L'energia che si libera all'atto della formazione dei legami tra nucleoni è la stessa che occorre per scindere il nucleo nei suoi componenti.
Un atomo individuato da queste due grandezze (A e Z) si chiama nuclide:
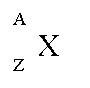
Le proprietà chimiche dell'atomo sono legate al numero di elettroni, e precisamente a quelli più esterni (corteccia elettronica). Le proprietà chimiche dell'atomo sono quindi legate al numero Z. Ordinando gli elementi secondo Z crescente (sistema periodico degli elementi) si osserva una spiccata periodicità di alcune importanti caratteristiche chimico-fisiche.
Isotopi
Elementi che hanno lo stesso numero atomico (Z) ma diverso numero di massa (A). I vari isotopi possono avere percentuali diverse nell'elemento in natura, ma la miscela isotopica rimane costante. Quindi, si può calcolare il peso atomico medio:
es. isotopi dell'idrogeno: 1H (99.98%) 2H (0.0156%) 3H (0.0044%)
Isobari
Elementi con uguale numero di massa e diverso numero atomico.
Struttura elettronica
Analogamente a quanto postulato per i "quanti di luce" (fotoni), anche agli elettroni viene attribuita una natura ondulatoria, oltre che corpuscolare: la materia, ai suoi limiti infinitesimi, si comporta quindi sia come un corpuscolo, sia come un'onda.
L'equazione che correla la natura corpuscolare (massa, m) e quella ondulatoria (lunghezza d'onda, l) per fotoni ed elettroni è simile:
per i fotoni: l = h/mc per gli elettroni: l = h/mv
dove h è la costante di ck, c e v sono le velocità delle particelle.
Sulla base di questa ipotesi, Schroedinger (1926) fece una trattazione matematica dei fenomeni inerenti alla natura ondulatoria dell'elettrone e sviluppò la "equazione d'onda" per descrivere lo stato energetico dell'elettrone. Anche per l'energia, come per la materia, si ammette una struttura "granulare", per cui l'energia non si trasmette da un sistema ad un altro con continuità, ma come una successione di quantità energetiche minime non frazionabili (quanti). Nel caso della radiazione elettromagnetica, l'energia del quanto varia in funzione della frequenza della radiazione: e = hu
La quantizzazione dell'energia permette agli elettroni di ruotare solo su determinati livelli energetici (orbitali), che corrispondono ai contenuti energetici degli elettroni che vi ruotano.
L'orbitale è una zona di altissima probabilità di presenza dell'elettrone attorno al nucleo ed è l'espressione matematica (funzione d'onda) che descrive lo stato energetico dell'elettrone.
Quando un atomo viene "eccitato", cioè sollecitato da una somministrazione energetica, i suoi elettroni possono assorbire tanta energia da assumere un contenuto quantico pari a quello di orbitali più esterni (a maggiore contenuto energetico) e quindi "saltare" su di essi. I diversi livelli energetici differiscono tra loro per almeno un quanto di energia. Cessato l'apporto energetico, gli elettroni ritornano sugli orbitali precedenti e l'atomo riprende il suo "stato fondamentale", emettendo l'energia precedentemente acquisita sotto forma di radiazione elettromagnetica di data frequenza: per ogni salto elettronico l'atomo perde un quanto di energia.
Regola dell'ottetto.
La presenza di un ottetto di elettroni nello strato più esterno conferisce particolare stabilità (= contenuto energetico potenziale minimo) all'atomo (è la struttura dei gas nobili!): gli atomi dei vari elementi tendono a conseguire una conurazione elettronica periferica a ottetto acquistando o cedendo effettivamente (ionizzazione) o formalmente (elettroni di valenza o di legame) un limitato numero di elettroni.
Fanno eccezione idrogeno (H), litio (Li) e berillio (Be) che, avendo pochi elettroni (1, 3 e 4) tendono ad avere un "doppietto" elettronico (stessa conurazione del neon, gas nobile, stabile).
Ionizzazione.
La ionizzazione (positiva o negativa) consiste nella cessione (positiva) o nell'acquisto (negativa) di elettroni da parte di atomi "instabili", che raggiungono così una conurazione elettronica periferica simile a quella di un gas nobile (ottetto stabile).
Esempi di ionizzazione positiva: i metalli alcalini si ionizzano perdendo 1 elettrone (gruppo IA, Na+, K+) o 2 elettroni (gruppo IIA, Mg2+, Ca2+) e raggiungono così la conurazione elettronica di un gas nobile (Ne e Ar, rispettivamente), a patto che sia loro fornita energia sufficiente a svincolare l'elettrone dalla forza di attrazione del nucleo (energia di ionizzazione).
Esempi di ionizzazione negativa: i non-metalli, O e S, e, F, Cl, I) invece si ionizzano acquistando 1 elettrone (gruppo VIIA, Cl-, I- ) o 2 elettroni (gruppo VIA, O2-, S2-,). In questo processo viene liberata energia, detta di "affinità elettronica".
Legame ionico
Ionizzandosi, l'atomo acquista stabilità elettronica, ma diventa carico elettricamente, quindi instabile elettricamente. Lo ione tende quindi a combinarsi con uno o più ioni di segno opposto per neutralizzare le rispettiva cariche (maggiore stabilità).
Nella formazione della molecola formale NaCl, l'affinità elettronica di un atomo (Cl) corrisponde esattamente all'energia di ionizzazione dell'altro atomo (Na): si forma così la molecola formale del cloruro di sodio (NaCl), che è un reticolo di ioni positivi e negativi tenuti insieme dall'interazione elettrostatica tra cariche di segno opposto (legame ionico).
Altri esempi di legame ionico:
K+ + F- KF (fluoruro di potassio)
K+ + I- KI (ioduro di potassio)
Mg2+ + 2Cl- MgCl2 (cloruro di magnesio)
Il legame non è stabile: in acqua NaCl si dissocia in Na+ e Cl- perché le molecole dell'acqua si inseriscono tra gli ioni diminuendo la forza di attrazione reciproca.
La capacità di uno ione di combinarsi con altri ioni di segno opposto si chiama anche "valenza": Cl- e I- sono ioni monovalenti negativi, Na+ e K+ sono ioni monovalenti positivi.
Nel legame ionico, la valenza quindi è il tipo e il numero di cariche elettriche portate dallo ione, che determinano il numero di legami ionici che quello ione può contrarre. Il termine valenza è anche usato nel caso del legame covalente, per indicare il numero di legami che un atomo può contrarre.
Legame covalente.
Il legame ionico non spiega tutti i tipi di composti: ad esempio non permetterebbe la formazione della molecola H-H (la molecola dell'idrogeno, H2). Non si può infatti pensare che un H acquisti 1 elettrone e l'altro H invece perda 1 elettrone.
Anche in questo caso vale la regola dell'ottetto (del "doppietto" per l'idrogeno), ma per conseguire questa struttura elettronica periferica, l'atomo anziché perdere o acquistare elettroni mette in tecipazione uno (o più) elettroni periferici con un altro atomo. Nel caso della molecola dell'idrogeno (H2), ogni atomo mette in tecipazione il suo elettrone con l'atomo vicino: i due elettroni saturano così un unico orbitale in tecipazione tra i due nuclei. La struttura elettronica così formata (2 elettroni intorno al nucleo di ciascun idrogeno) è simile a quella del gas nobile elio (He).
Nel caso che i due atomi che contraggono il legame covalente siano uguali, gli elettroni sono perfettamente condivisi ("equidistanti") tra i due contraenti il legame: questo legame si chiama covalente apolare (esempi: H2, F2, O2). Questo legame è molto forte e non si dissocia in acqua (al contrario del legame ionico).
Nel caso invece che gli atomi che contraggono il legame covalente siano diversi, non c'è questa perfetta simmetria molecolare: ad esempio, nel caso della molecola dell'acido cloridrico (HCl), il cloro ha una affinità elettronica (tendenza ad attrarre gli elettroni, elettronegatività) molto maggiore dell'idrogeno. Quindi, gli elettroni tecipati nel legame (uno per ciascun atomo) tendono a spostarsi verso il cloro: il legame che si forma si chiama covalente comune, e mostra una tendenza alla polarità: sul cloro si forma un "polo negativo" e sull'idrogeno un "polo positivo".
nube elettronica di legame
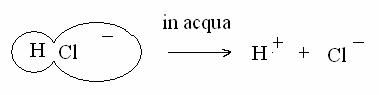
Nella forma gassosa del HCl prevale la tendenza al legame covalente, mentre una volta sciolto in acqua, che dissocia (separa) i contraenti del legame, HCl si dissocia in H+ e Cl-.
Un
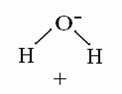
altro esempio di legame covalente comune si trova nella molecola dell'acqua (H2O).
Nel legame tra l'ossigeno e ciascuno dei due idrogeni ogni atomo mette in
tecipazione con l'altro 1 elettrone: poiché l'ossigeno è molto
più elettronegativo dell'idrogeno, gli elettroni di legame sono
più spostati sull'ossigeno. Quindi sull'ossigeno c'è una parziale
carica positiva e sugli idrogeni c'è una parziale carica negativa: la
molecola dell'acqua è quindi un dipolo.
Questo fatto ha conseguenze importanti sulle proprietà fisiche dell'acqua: tra le molecole d'acqua si formano infatti dei legami elettrostatici (tra carica + e carica -) che racchiudono le molecole in una specie di reticolo (pseudocristallo). Questi legami intermolecolari (tra molecole diverse), che si chiamano "ponti idrogeno", sono responsabili del fatto che l'acqua sia liquida a 37°C. La temperatura di ebollizione dell'acqua è 100°C, mentre quella dell'acido solfidrico (H2S) è -60°C, perché H2S non forma ponti idrogeno intermolecolari (perché il diametro dell'atomo di zolfo è molto maggiore del diametro dell'ossigeno, quindi S è troppo distante da H per indurne la protonazione).
Formazione di ponti idrogeno tra molecole
d'acqua.
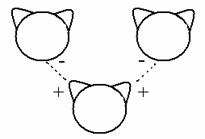
I ponti idrogeno sono legami intermolecolari deboli, ma rivestono grande importanza in biochimica: sono i legami responsabili della struttura delle proteine e del DNA.
Infine, un altro tipo di legame covalente è il legame covalente semipolare o dativo, che si verifica quando il doppietto elettronico di legame, anziché formarsi per mutuo scambio di elettroni tra i due atomi del legame, viene fornito completamente da uno dei due atomi interessati (donatore). Per esempio, nello ione ammonio (NH4+) tre idrogeni sono legati all'azoto con legami covalenti comuni, mentre il quarto ione idrogeno (H+) è legato con un legame covalente dativo, dove entrambi gli elettroni del legame sono forniti dall'azoto.
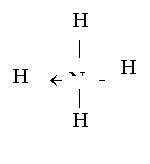
Riassumendo, i legami atomici (intramolecolari) sono:
Per contro, i legami intermolecolari sono:
Energia di legame
All'atto della formazione di un legame chimico si libera energia (è proprio questo il motivo per cui si forma il legame: il contenuto energetico della molecola che ne risulta si abbassa, cioè la molecola prodotta è più stabile dei reagenti). Questa energia si chiama energia di legame, ed è la stessa quantità di energia che dovrei somministrare per rompere lo stesso legame. Quindi questa energia può essere misurata:
C-C 83 kcal /mole di legami 1 mole sono 6.023 x 1023 legami
C=C 83 + 65 = 148 kcal/mole
Ponte idrogeno < 1 kcal/mole
Elettronegatività
L'elettronegatività di un atomo è una misura della sua tendenza a catturare elettroni. Si manifesta quando atomi diversi si avvicinano: quello a maggiore elettronegatività tenderà ad acquistare elettroni (uno o più), quello a minore elettronegatività tenderà invece a perderli per conseguire entrambi l'ottetto elettronico periferico. Il legame covalente o ionico che si forma stabilizza la molecola. Confrontando atomi diversi è possibile stilare una "scala di elettronegatività": la differenza di elettronegatività tra due atomi consente di calcolare la percentuale di ionicità del legame che si forma tra essi:
diff. di elettronegatività 1 2 3
% di ionicità legame 20 60 90
La scala di elettronegatività consente quindi di fare previsioni sul tipo di legami atomici nelle molecole allo stato puro (in assenza di acqua!).
L'elettronegatività aumenta lungo i periodi della tavola periodica degli elementi da sinistra verso destra e diminuisce lungo i gruppi (dall'alto in basso).
Numero di ossidazione
Il numero di ossidazione è il numero di elettroni formalmente perduti (e allora sarà positivo) o acquistati (in questo caso sarà negativo) da un atomo nel o nei legami covalenti all'interno di una molecola. (Nel legame ionico, il numero di elettroni effettivamente persi o acquistati si chiama "valenza"). Il calcolo del numero di ossidazione è importante per capire se in una reazione chimica un certo atomo abbia aumentato il suo numero di ossidazione, "perdendo" elettroni (cioè si sia ossidato) o abbia diminuito il suo numero di ossidazione, "acquistando" elettroni (cioè si sia ridotto).
Esempio 1: acido nitroso (HNO2)
Poiché può dissociarsi in H+ + NO2- l'idrogeno non è legato all'atomo centrale nella molecola (N), bensì all'ossigeno:
O=N-OH
valori di elettronegatività: O=3.5; N=3; H=2;
La differenza di elettronegatività tra gli atomi è abbastanza piccola (1-l.5) per cui la percentuale di ionicità nei legami è piccola (<30%): si tratta di legami covalenti comuni.
H ha n° di ossidazione +1 (quasi sempre)
O ha n° di ossidazione -2 (quasi sempre)
N ha n° di ossidazione +3
Esempio 2: alcol primario (R-CH2OH) R è il resto della molecola carboniosa
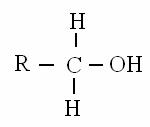
valori di elettronegatività: O=3.5; C=2.5; H=2
H ha n° di ossidazione +1
C ha n° di ossidazione -2+1 = -l
O ha n° di ossidazione -l + (-l) = -2
Nel gruppo alcolico primario il carbonio ha n° di ossidazione -l, nel gruppo aldeidico ha n° di ossidazione +1 e nel gruppo carbossilico ha n° di ossidazione +3: quindi nella reazione da alcol ad aldeide e da aldeide ad acido il carbonio diventa sempre più ossidato.
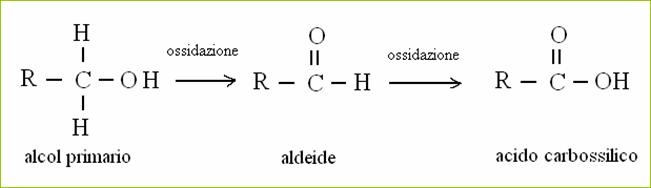

Ossido-riduzione
L'ossidazione è la perdita di elettroni da parte di un composto, mentre la riduzione è l'acquisto di elettroni da parte di un composto. Poiché gli elettroni non possono rimanere isolati (cioè quando vengono persi da un sistema devono rientrare in un altro) si parla di sistema o reazione di ossido-riduzione.
In una generica reazione di ossido-riduzione:
Xox + Yrid Xrid + Yox
il composto X si riduce (acquista elettroni) e contemporaneamente il composto Y si ossida (perde un uguale numero di elettroni). Si verifica cioè un passaggio di elettroni tra due composti diversi (e non tra due ioni all'interno di uno stesso composto come nella ionizzazione). Il donatore di elettroni (Y) è il riducente e l'accettore di elettroni (X) è l'ossidante. In ogni caso si verifica contemporaneità ed equivalenza elettronica delle reazioni di ossido-riduzione.
Per sapere quale, tra due composti, si comporterà da riducente e quale da ossidante si guarda la loro posizione nella scala di elettronegatività.
Esempio 1: Fe + O FeO (ossido ferroso)
Nella scala di elettronegatività il Fe ha valore 1.8 e l'ossigeno ha valore 3.5 (maggiore). Quindi l'ossigeno ha molta maggiore affinità per gli elettroni del ferro.
In questa reazione il Fe perde 2 elettroni e diventa Fe2+; contemporaneamente l'ossigeno (monoatomico, di solito O2) acquista 2 elettroni e diventa O2-. Quindi in questa reazione il ferro si ossida e l'ossigeno si riduce.
Il ferro può esistere in tre stati di ossidazione:
Fe (ferro, n° ox = 0); Fe2+ (ione ferroso; n° ox = +2); Fe3+ (ione ferrico; n° ox = +3)
Esempio 2: Cu + 2Br CuBr2 (bromuro rameico)
Nota: l'ossidazione NON è necessariamente la combinazione con l'ossigeno!
Nella scala di elettronegatività il rame ha valore 1.9 mentre il bromo ha valore 2.8 (maggiore). Quindi il bromo ha maggiore affinità del rame per gli elettroni.
In questa reazione il rame perde 2 elettroni e il bromo acquista 2 elettroni, quindi il rame si ossida e il bromo si riduce.
Il rame può esistere in tre stati di ossidazione:
Cu (rame, n° ox = 0); Cu+ (ione rameoso, n° ox = +1); Cu2+ (ione rameico, n° ox = +2).
Serie elettrochimica degli elementi.
Tra forma ionica e forma elementare di uno stesso elemento si può instaurare un equilibrio ossido-riduttivo. Si immerga una sbarretta dell'elemento nella soluzione di un suo sale (semipila):
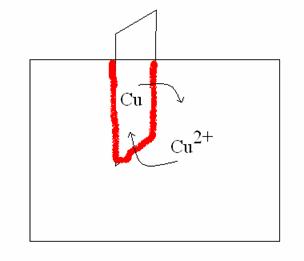
Per la tensione elettrolitica di soluzione il rame elementare passa in soluzione diventando ione rameico (Cu2+) e lascia elettroni sulla sbarretta (che diventa carica negativamente).
Per la pressione osmotica delle cariche lo ione rameico tende ad assumere elettroni e diventare neutro, depositandosi sulla sbarretta (che perde cariche negative).
Se l'equilibrio tra le due forze fosse spostato verso la forma atomica, alla fine della reazione la sbarretta peserebbe di più. Se la reazione fosse spostata verso la forma ionica, la sbarretta peserebbe di meno. In ogni caso, tra sbarretta e soluzione (cioè tra Cu e Cu2+) si verifica per breve tempo una differenza di potenziale misurabile in volt.
Confrontando coppie di elementi (forma elementare e forma ionica dello stesso elemento) con una semipila di confronto (per convenzione rappresentata dall'equilibrio H2/H+ 0 volt) si può stabilire il potenziale redox (o forza elettron motrice -fem- standard) delle varie coppie e stabilire così una graduatoria degli elementi (serie elettrochimica degli elementi). La tabella delle fem standard di ossido-riduzione consente di predire il flusso di elettroni durante una reazione chimica di ossido-riduzione tra elementi diversi, cioè di predire chi si comporterà da riducente (ossidandosi, cioè perdendo elettroni) e chi si comporterà da ossidante (riducendosi, cioè acquistando gli elettroni perduti dal riducente).
Equivalente di ossido-riduzione: quantità in uma di una sostanza in grado di scambiare 1elettrone. Es. per Na+ 23 uma; per Cu2+ 63/2 uma
Grammo-equivalente di ossido-riduzione: quantità in grammi di una sostanza che scambia 1 mole di elettroni.
Equilibri chimici
Una trasformazione chimica (A + B C + D + energia) avviene perché il contenuto energetico del sistema (A + B) è superiore a quello minimo potenziale: il sistema deve scaricare l'eccesso di energia potenziale trasformandosi.
Nella reazione di cui sopra, dopo un certo tempo, si stabilisce un equilibrio:
A + B C + D
Si tratta di un equilibrio dinamico: non è che non avvengano più trasformazioni, ma tante molecole di A e B si trasformano in C e D quante molecole di C e D si trasformano in A e B. In altre parole: all'equilibrio, non cambiano più le quantità relative di reagenti e prodotti. A seconda delle reazioni, l'equilibrio può essere spostato maggiormente verso i reagenti o verso i prodotti.
Se, una volta raggiunto l'equilibrio, si aggiungesse altro reagente o si sottraesse prodotto, la reazione riprenderebbe verso destra fino a un nuovo equilibrio.
La quantità di molecole si quantizza con il numero di moli (1 mole = 6x1023 molecole) e poiché di solito si tratta di reazioni che avvengono in sistemi omogenei (soluzioni) la concentrazione di reagenti e prodotti si quantizza in moli/litro.
Legge dell'azione di massa (soluzioni omogenee a T cost).
La velocità di trasformazione di un sistema è direttamente proporzionale alle masse non ancora trasformate in un dato momento: la reazione è tanto più veloce quante più molecole ci sono che devono ancora trasformarsi.
Nella reazione:
A + B C + D
ad un tempo t, la velocità di reazione verso destra sarà proporzionale alle concentrazioni dei reagenti non ancora trasformati: v1 = K1 (A x B)
La velocità di reazione verso sinistra sarà proporzionale alle concentrazioni dei prodotti già formati: v2 = K2 (C x D).
Quando v1 = v2 si è raggiunto l'equilibrio:
K1 (A x B) = K2 (C x D)
Riordinando, si ottiene:
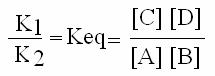
dove Keq è la costante di equilibrio della reazione e le parentesi quadre intorno ai simboli di reagenti e prodotti indicano le loro concentrazioni molari (cioè moli/litro di soluzione).
Se Keq > 1 l'equilibrio è spostato verso i prodotti; se Keq < 1 l'equilibrio è spostato verso i reagenti. L'equilibrio di reazione (ad una data concentrazione di reagenti e prodotti) dipende solo dalla natura chimica di reagenti e prodotti: la presenza di un catalizzatore accelera il raggiungimento dell'equilibrio, ma non lo sposta. Il catalizzatore stesso rimane inalterato nella reazione.
Acidità e basicità di soluzioni acquose
Acida è una sostanza che libera ioni H+ in soluzione. Basica è una sostanza che libera ioni OH- in soluzione (che neutralizzano i protoni formando acqua) o che rimuove ioni H+ dalla soluzione (ad es. l'ammoniaca, NH3, è basica perché in soluzione può protonarsi diventando ione ammonio, NH4+, e sottraendo H+ dalla soluzione).
Dissociazione dell'acqua
Dalla dissociazione di una molecola d'acqua si forma uno ione H+, che impartisce acidità e uno ione OH- che impartisce basicità. Quindi si formano tanti H+ quanti OH- e infatti l'acqua non è né acida né basica (neutralità).
H2O H+ + OH-
A 25°C, per ogni 109 molecole d'acqua se ne dissociano solo 2. Quindi l'equilibrio della reazione di dissociazione dell'acqua è molto spostato verso sinistra (Keq è molto piccola).
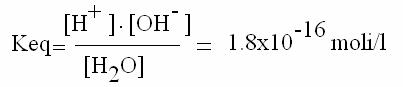
riordinando: [H+] [OH-] = 1.8x10-l6 [H2O]
La frazione di molecole d'acqua che si dissocia è talmente piccola che si può considerare trascurabile: quindi, la [H2O] prima e dopo la dissociazione è circa la stessa.
Qual'è la concentrazione dell'acqua nell'acqua (cioè il termine [H2O] dell'equazione sopra)? In altre parole, quante moli d'acqua ci sono in 1 litro d'acqua?
1l d'acqua pesa 1Kg (1000g); il peso molecolare dell'acqua è 18, quindi 18g d'acqua contengono 1 mole (6x1023) di molecole d'acqua: 1000g contengono 1000/18 moli d'acqua. Inseriamo questo valore al posto della [H2O] nell'equazione sopra:
[H+] [OH-] = 1.8x10-l6 1000/18
[H+] [OH-] = 10-l4
[H+] [OH-] si chiama prodotto ionico dell'acqua (Kw) ed è una costante (a T costante).
Nell'acqua (senza aggiunta di acidi o basi):
[H+] = [OH-] = 10-7 moli/l
Aggiungendo H+ all'acqua (aggiungendo un acido), la dissociazione dell'acqua si modificherà in modo che [H+] [OH-] sia sempre 10-l4: quindi diminuirà la [OH-]. Viceversa, aggiungendo OH- all'acqua (aggiungendo una base), diminuirà la [H+]. Si può quindi tracciare una scala di concentrazioni di H+ e OH- che, partendo dalla neutralità ([H+] = [OH-] = 10-7 moli/l) va verso l'acidità (per aggiunta di H+) o verso la basicità (per aggiunta di OH-).
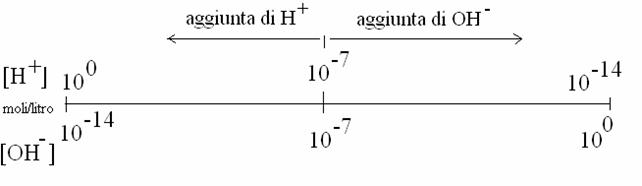
Per semplificare i numeri della scala di acidità e basicità (che sono esponenziali e negativi) si è convenuto di :
eliminare la base 10 e considerare solo gli esponenti
cambiarne il segno da negativo a positivo
La scala pertanto diventa la seguente:
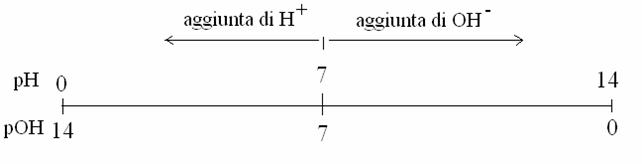
L'operazione matematica che è stata fatta si riassume nelle formule:
pH = -log [H+]
pOH = -log [
la p minuscola significa che della concentrazione molare di H+ o di OH- si considera il logaritmo in base 10 (esponente), cambiato di segno.
Una soluzione è neutra (uguale concentrazione di H+ e OH-) a pH 7: tra pH 7 e pH 0 è acida e tra pH 7 e pH 14 è basica. Il prodotto ionico dell'acqua si può adesso riscrivere come:
pH + pOH = 14
Occorre ricordare che tra due unità di pH (per es. tra pH 7 e pH 6) c'è una differenza di [H+] di 10 volte!
Acidi forti e basi forti si dissociano completamente in acqua.
Esempi:
acido cloridrico HCl H+ + Cl- idrossido di sodio NaOH Na+ + OH-
acido solforico H2SO4 2H+ + SO4 2- idrossido di potassio KOH K+ + OH-
acido nitrico HNO3 H+ + NO3-
La costante di dissociazione di un acido forte è >>1
Il pH di una soluzione di un acido (o di una base) forte si calcola quindi dalla sua concentrazione molare (moli/l) moltiplicata per quanti H+ produce per molecola dissociata: la molarità degli H+ o degli OH- in soluzione si chiama "normalità" e si indica con N. Una soluzione 1 N contiene 1 mole di ioni H+ o OH- per litro di soluzione.
Esempio 1: una soluzione 1M di HCl (1H+ per molecola dissociata, quindi 1N) avrà pH = - log 1 = 0; una soluzione 0.1 M di HCl avrà pH = - log 0.1 = - (-l) = 1.
Esempio 2: una soluzione 0.05M di H2SO4 (2H+ per molecola dissociata, quindi 0.05x2 = 0.1N) avrà pH = - log 0.1 = 1.
Esempio 3: una soluzione 0.1M di NaOH (1OH- per molecola dissociata, quindi 1N) avrà pOH = - log 0.1 = 1; poiché pH + pOH = 14, possiamo calcolare il pH:
pH = 14 - pOH = 13.
Acidi deboli e basi deboli invece non si dissociano completamente in acqua.
La costante di dissociazione di un acido forte è <<1
Esempi:
acido carbonico H2CO3 H+ + HCO3-
acido acetico CH3COOH H+ + CH3COO-
La misura del pH di una soluzione si può fare con degli indicatori di pH che cambiano colore al variare del pH (ad esempio le cartine al tornasole) oppure, in modo più preciso, con uno strumento che si chiama pHmetro. Una sonda misura la differenza di potenziale che si crea tra una soluzione a pH noto, posta nell'elettrodo "di riferimento", e la soluzione da misurare.
Idrolisi
Un sale formato dalla reazione tra un acido e una base forti (es. KCl) sciolto in acqua si dissocia completamente e gli ioni che si formano non mostrano alcuna tendenza a riformare acido e base di origine reagendo con H+ + OH- formati dalla dissociazione dell'acqua. Il pH della soluzione rimane invariato.
KCl K+ + Cl-
H2O H+ + OH-
KCl + H2O K+ + Cl- + H+ + OH-
Invece, un sale formato dalla reazione tra un acido debole e una base forte, una volta sciolto in acqua, tende in parte a riassociarsi con H+ (prodotto dalla dissociazione dell'acqua) per formare l'acido debole di origine.
CH3COONa CH3COO- + Na+
H2O H+ + OH-
CH3COONa + H2O CH3COOH + Na+ + OH-
La riassociazione lascia però un eccesso di OH- rispetto agli H+, e quindi induce un aumento del pH della soluzione (che diventa alcalina).
Tamponi
Il pH del sangue deve rimanere compreso entro limiti molto ristretti (può variare al massimo nella 2a cifra decimale, tra 7.38-7.35): una sua modificazione verso l'acidità (acidosi) o la basicità (alcalosi) comporta danni tessutali gravi e può portare alla morte. Questo è vero in generale per tutti i liquidi extra- ed intra-cellulari: una variazione del pH comporta gravi conseguenze sulla funzionalità degli enzimi (i catalizzatori delle reazioni chimiche nelle cellule) e può arrestare il metabolismo cellulare.
Una soluzione tampone è una soluzione che si oppone a variazioni del suo pH indotte dall'aggiunta di acidi o di basi (entro certi limiti!). Per i motivi sopra citati, non sorprende che i principali liquidi organici (plasma, linfa, liquido intracellulare) siano soluzioni tampone.
Una soluzione tampone contiene:
un acido debole più un suo sale, fatto con una base forte; oppure
una base debole più un suo sale, fatto con un acido forte
Esempio 1: tampone acetato/acido acetico
acido acetico (debole) CH3COOH CH3COO- + H+
acetato di sodio (sale con NaOH) CH3COONa CH3COO- + Na
L'equilibrio di dissociazione dell'acido è spostato verso sinistra (acido debole), invece l'equilibrio di dissociazione del sale è spostato tutto verso destra (dissociato).
Se si aggiungono H+ in soluzione (aggiunta di un acido), lo ione acetato (CH3COO-) tende a riassociarsi con H+ per dare l'acido debole CH3COOH: finchè c'è acetato disponibile quindi, il pH della soluzione non cambia perché gli H+ aggiunti non restano in soluzione ma vengono "tamponati" dallo ione acetato.
Se si aggiungono OH- (aggiunta di una base), questi tendono ad associarsi con gli H+ dissociati dall'acido acetico per dare acqua: finchè c'è acido disponibile il pH della soluzione non cambia perché gli OH- aggiunti vengono "tamponati" dall'acido.
La capacità tamponante della soluzione tampone non è infinita: dipende dalla quantità di ione acetato (che tampona l'acidità) e di acido acetico (che tampona la basicità).
Esempio 2 : tampone bicarbonato/acido carbonico (è il tampone del sangue!)
acido carbonico H2CO3 HCO3- + H+
bicarbonato NaHCO3 Na+ + HCO3-
Il tampone del sangue è proprio questo perché la CO2 che espiriamo (prodotta dall'attività metabolica cellulare) in soluzione acquosa (nel plasma) forma acido carbonic, secondo la reazione: CO2 + H2O H2CO3 HCO3- + H+
Gli ioni bicarbonato si combinano con gli ioni Na+ (gli ioni positivi più abbondanti nel plasma) formando NaHCO3.
Il pH di una soluzione tampone si calcola con la formula:
pH = pKa + log [sale]/[acido]
dove Ka è la costante di dissociazione dell'acido.
Il potere tamponante si esercita al meglio entro 1 unità di pH sopra e sotto la costante di dissociazione dell'acido debole: pH = pKa
Termodinamica chimica
Quando scriviamo l'equazione di una reazione chimica nel modo seguente:
A + B C + D
tralasciamo un aspetto importante, cioè l'energia scambiata durante la trasformazione (una trasformazione chimica avviene perché il sistema ha un contenuto energetico potenziale troppo alto - oppure perché viene fornita energia al sistema, ad esempio calore).
In realtà, quindi: A + B C + D DH
Dove DH è il calore scambiato (entalpia) durante la reazione: questa quantità di energia corrisponde a una quantità di materia piccolissima (non misurabile) che si è trasformata in energia nel corso della reazione.
Esempio 1: C + O2 CO2 + 94 kcal DH = -94 kcal/mole
negativo perché calore perduto
12g + 32g 44g +
94 kcal
questa reazione è esotermica (sviluppa calore)
Esempio 2: 43 kcal + H2 + Cl2 2HCl DH = 43 kcal/mole
positivo perché calore richiesto
43 kcal + 2g + 71g 73g
questa reazione è endotermica (richiede calore)
Le reazioni esotermiche in genere sono spontanee e le reazioni endotermiche in genere non sono spontanee: ma la spontaneità della reazione non dipende solo dal calore scambiato (DH). Occorre considerare anche la variazione del disordine molecolare (entropia) del sistema durante la trasformazione. Un aumento del disordine molecolare del sistema durante la trasformazione la favorisce. La variazione di entropia è definita dal termine TDS.
Quindi, la spontaneità di reazione dipende sia dal calore scambiato (DH), che dalla variazione del disordine molecolare (TDS).
Definiamo una grandezza che leghi queste due funzioni di stato, l'energia libera (G):
DG = DH - TDS
Questa equazione significa: la variazione di energia libera di un sistema durante una trasformazione chimica (energia finale - energia iniziale) dipende dalla variazione di entalpia e dalla variazione di entropia. Una reazione endotermica (DH > 0) può essere spontanea, se la variazione di entropia è positiva (aumenta il disordine molecolare durante la trasformazione) e maggiore del consumo di calore.
Una reazione è spontanea se DG < 0 (reazione esoergonica). Se DG > 0, la reazione non avviene nella direzione in cui è scritta (endoergonica), mentre è spontanea nella direzione opposta. Quando DG = 0 la reazione è all'equilibrio.
Quindi, la variazione di energia libera durante una trasformazione è una misura della tendenza del sistema a trasformarsi.
Il bilancio energetico della reazione (cioè il DG) dipende solo dallo stato iniziale e dallo stato finale, qualunque sia stata la "strada" chimica seguita dal sistema per trasformarsi.
Che relazione c'è tra DG e costante di equilibrio della reazione? In sostanza, ci danno entrambe una misura della tendenza della reazione ad avvenire nel senso indicato dalla freccia. Abbiamo detto sopra che quando Keq > 1 l'equilibrio di reazione è spostato verso i prodotti, quindi DG sarà negativo. Viceversa, quando Keq < 1, l'equilibrio è spostato verso i reagenti e DG sarà positivo.
Vediamo ora più nel dettaglio come varia il contenuto di energia libera del sistema durante una reazione tipo: A + B C + D DG < 0 (reazione spontanea)
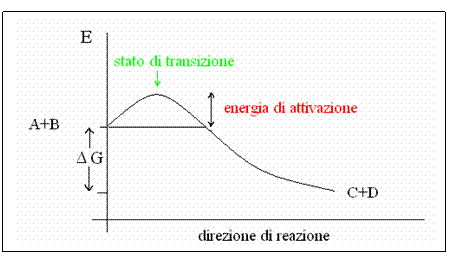

La variazione di energia libera (DG) è negativa (contenuto energetico dei prodotti minore dei reagenti), quindi la reazione procede spontaneamente verso i prodotti. Però energeticamente, la "strada" verso i prodotti non è tutta in discesa: i reagenti devono passare attraverso uno stato a maggiore contenuto energetico (stato di transizione) prima di potersi trasformare nei prodotti. L'energia di attivazione è quella quantità di energia necessaria per portare tutte le molecole dei reagenti allo stato di transizione.
Per fare un paragone, immaginiamo di rompere a metà un pezzo di legno: dobbiamo prima piegarlo. Nel momento in cui è piegato (ma non ancora spezzato) ha un contenuto energetico maggiore del pezzo di legno a riposo (per esempio può sfuggirmi di mano e rompermi un dente). Questo stato corrisponde allo stato di transizione. A questo punto, il più è fatto e la "reazione" procede con la rottura completa del pezzo di legno in due frammenti (i prodotti della reazione).
Lo stato di transizione viene raggiunto statisticamente da un certo numero di molecole nell'unità di tempo, che si vengono a trovare momentaneamente in uno stato di maggiore contenuto energetico. Più alta è la "collinetta" da superare, però, e minore sarà il numero di molecole che riusciranno a superarla, nell'unità di tempo.
Un catalizzatore (per esempio, gli enzimi) abbassa l'energia di attivazione della reazione, formando un complesso con i reagenti, aiutandoli ad assumere lo stato di transizione. Quindi, nell'unità di tempo, più molecole riusciranno a superare la barriera di attivazione: la reazione sarà accelerata, ma il DG della reazione NON cambia perché dipende solo dalla natura chimica di reagenti e prodotti e non dal percorso energetico della trasformazione.
Per tornare all'esempio del pezzo di legno, il catalizzatore in questo caso potrebbe essere una morsa che tiene il pezzo di legno un po' piegato e mi facilita il compito di romperlo.
Nel caso degli enzimi, questi legano il substrato distorcendone un po' la molecola, in modo che nel complesso enzima-substrato il substrato assomiglia più al suo stato di transizione che al substrato nativo. In definitiva, il catalizzatore abbassa l'energia di attivazione, ma non sposta l'equilibrio di reazione (non modifica DG né Keq).
Soluzioni
Una soluzione è un sistema omogeneo (una singola fase) di almeno 2 sostanze pure intimamente miscelate a livello molecolare. La sostanza presente in quantità maggiore (che funge da diluente) e che di solito ha molecole più piccole, è detta solvente; le altre si chiamano soluti. Il meccanismo con cui si forma una soluzione è che le molecole del solvente circondano e isolano una dall'altra le molecole del soluto (che diventano "solvatate"). La solvatazione richiede la formazione di legami deboli tra soluto e solvente.
Nelle soluzioni acquose, per esempio, tali legami sono interazioni elettrostatiche che si instaurano tra cariche di segno opposto sulla molecola del solvente e dell'acqua.
Solvatazione
del cloruro di sodio da parte delle molecole dell'acqua. Gli ossigeni
dell'acqua hanno una parziale carica
negativa e circondano gli ioni Na+. Gli idrogeni hanno una
parziale carica positiva e circondano gli ioni Cl-.
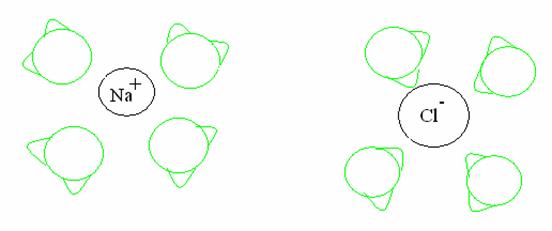
Lo ione Na+ sarà circondato dagli atomi di ossigeno delle molecole d'acqua di solvatazione (che hanno una parziale carica negativa), mentre lo ione Cl- sarà circondato dagli idrogeni delle molecole d'acqua di solvatazione (che hanno parziale carica positiva). In questo modo, l'acqua rompe il legame elettrostatico tra Na+ e Cl- e il sale "si scioglie" in acqua.
Per sciogliersi in acqua, il soluto deve poter fare legami elettrostatici con le molecole d'acqua: quindi, sono solubili in acqua molecole cariche o polari (che possono fare legami idrogeno con le molecole d'acqua; es. zuccheri, amminoacidi). Non saranno solubili in acqua molecole apolari o prive di cariche elettriche (es. trigliceridi, colesterolo).
Le particelle di soluto tendono a occupare uniformemente tutto lo spazio disponibile (in analogia con i gas) ed esercitano contro le pareti del recipiente una pressione, detta pressione osmotica. Per misurare tale pressione, si sfrutta la capacità di una membrana semipermeabile di lasciare passare solo le molecole di solvente.
La pressione osmotica è una delle proprietà colligative delle soluzioni: si tratta di proprietà fisiche, che non dipendono dalla natura chimica del soluto, ma solo dalla sua concentrazione: le altre proprietà colligative sono l'abbassamento della tensione di vapore, l'innalzamento ebullioscopio, l'abbassamento crioscopico.
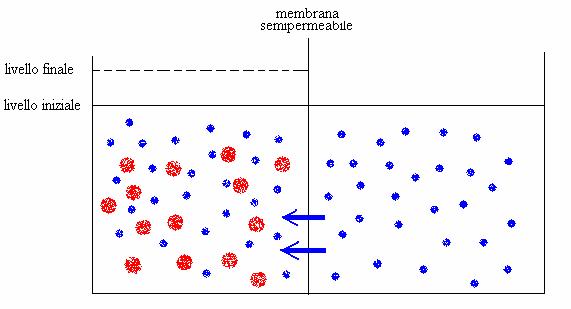
Immaginiamo di avere due recipienti, separati da una membrana semipermeabile (cioè permeabile solo al solvente): in uno c'è solo il solvente (pallini blu), nell'altro c'è anche del soluto (pallini rossi). All'inizio dell'esperimento, il livello del solvente nei due recipienti è lo stesso: la "richiesta" di nuovo volume in cui diffondere da parte delle particelle di soluto richiama solvente attraverso la membrana e il livello nel recipiente di sinistra aumenterà. La pressione che bisognerebbe esercitare sulla superficie del solvente a sinistra (ad esempio con uno stantuffo) per evitare l'innalzamento del livello è una misura della pressione osmotica del soluto. Questa pressione si calcola dalla formula:
p = n c RT
p è la pressione osmotica (in atmosfere);
n è il coefficiente di dissociazione del soluto, cioè in quanti ioni si dissocia la molecola del soluto quando si scioglie (per NaCl n = 2; per il glucosio, che non si dissocia, n = 1)
c è la concentrazione molare del soluto (moli/litro)
R è la costante dei gas; 0.082 l atm/moli °K
T è la temperatura assoluta, in °K
Il termine "n c" dell'equazione sopra indica la molarità di tutte le particelle in soluzione, cioè la osmolarità. Quindi:
osmolarità (osm/l) = molarità (moli/l) x coefficiente di dissociazione
Dialisi
Le proprietà della membrana semipermeabile sono sfruttate a fini terapeutici nella tecnica della dialisi: in questo caso, un tipo speciale di membrana semipermeabile funziona da setaccio molecolare lasciando passare molecole di soluto piccole, ma trattenendo quelle grandi. Scegliendo opportunamente la composizione ionica del liquido di dialisi, si può indurre l'uscita dal sacchetto di dialisi di soluti piccoli, conservando all'interno del sacchetto i soluti grandi. Una applicazione importante di questa tecnica è la dialisi del sangue, che consente la rimozione di molecole piccole (veleni, urea) senza privare il plasma dei suoi costituenti proteici.
Il principio
della dialisi: nel sacchetto formato con la membrana da dialisi è
contenuta una soluzione mista, con vari soluti piccoli (verdi e blu) e
grandi (rossi). Poiché nel liquido di dialisi si trova il soluto verde
(alla stessa concentrazione presente nel sacchetto), ma non quello blu,
solo quest'ultimo tenderà ad uscire dal sacchetto. I soluti rossi
non escono dal sacchetto perché sono troppo grandi per passare attraverso i
pori della membrana. Esistono membrane da dialisi con diverse grandezze dei
pori.
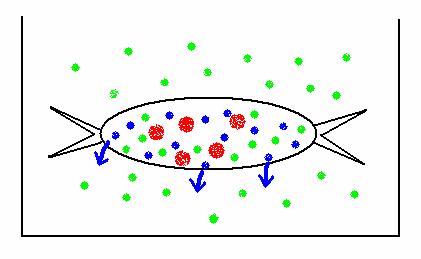
Emolisi
Un'altra importante (questa volta pericolosa!) implicazione medica del principio della dialisi è l'emolisi. La membrana cellulare (di tutti i tipi cellulari) funziona un po' come una membrana semipermeabile: lascia passare liberamente l'acqua, ma non i soluti. Quindi, se gli eritrociti (o qualunque altro tipo cellulare) vengono a contatto con una soluzione avente una osmolarità inferiore a quella della cellula, l'acqua tenderà a entrare dentro le cellule, facendo rigonfiare la membrana cellulare fino a romperla (emolisi ipotonica). Viceversa, se gli eritrociti vengono a contatto con una soluzione avente una osmolarità maggiore di quella della cellula, l'acqua tenderà a uscire dalle cellule (raggrinzimento ipertonico). In ogni caso, la cellula ne risulta gravemente danneggiata, fino alla morte.
L'osmolarità intracellulare ha un valore noto: 0.3 osm (0.3 osmolare, cioè 0.3 osmoli/l). Quindi le soluzioni che vengono iniettate endovena devono avere la stessa osmolarità. Le due soluzioni più frequentemente usate per via endovenosa sono la soluzione salina di NaCl (detta "fisiologica") e la soluzione glucosata. Entrambe hanno osmolarità di 0.3 osm. La molarità, però, è diversa. Infatti, mentre NaCl ha coefficiente di dissociazione 2, il glucosio, che non si dissocia, ha coefficiente 1.
Soluzione salina: 0.3 osm = molarità x 2
Soluzione glucosata: 0.3 osm = molarità x 1
Quindi, una soluzione fisiologica (isotonica col sangue), si ottiene con NaCl 0.15 M o con glucosio 0.3 M.
Una osmolarità corretta non è l'unico requisito per poter infondere una soluzione endovena: il pH deve essere neutro!
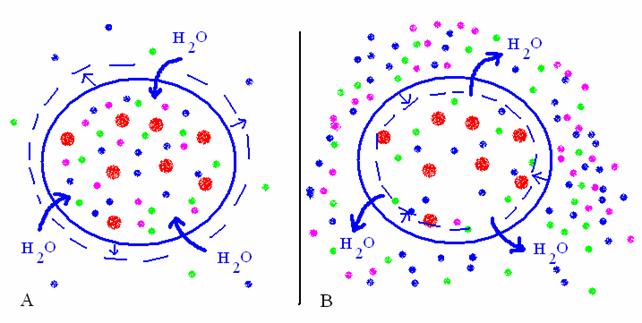
Modificazioni del volume cellulare a
seconda dell'osmolarità del mezzo.
Le misure di concentrazione più utilizzate sono le seguenti.
Percentuale peso/volume (% p/v):
Es. : una soluzione al 10% di NaCl in acqua contiene 10g di NaCl per 100 ml di soluzione (non di solvente!)
Questa soluzione si fa pesando 10g di NaCl, mettendoli in un cilindro graduato e aggiungendo acqua fino a 100ml.
Molarità (M)
Es. : una soluzione 0.3 M di NaCl in acqua contiene 0.3 moli di NaCl per litro di soluzione
La molalità sono le moli di soluto per Kg di solvente.
Osmolarità (Osm)
Es. : una soluzione 0.3 M di NaCl è 0.3 x 2 = 0.6 osm; una soluzione 0.3 M di glucosio (che non si dissocia) è 0.3 osm
Esercizi sulle misure di concentrazione:
Quanti g di NaCl (PM = 58) occorrono per fare 250 ml di una soluzione 0.15 M ?
58 x 0.15 x 0.25g
2) Quanti g di KCl (PM = 74) occorrono per fare 500 ml di una soluzione al 10% (p/v).
Una soluzione al 10% p/v contiene 10g in 100 ml di soluzione. Quindi, per fare 500 ml ci vogliono 10/100 x 500 g
3) Quanti g/l di NaCl (PM 58) contiene una soluzione fisiologica?
Calcoliamo prima la molarità della soluzione. Sappiamo che la soluzione fisiologica è 0.3 osm: poiché NaCl si dissocia in 2 ioni (coefficiente di dissociazione = 2), la molarità sarà 0.3/2 = 0.15 M (cioè 0.15 moli/litro). Una mole è il peso molecolare in g: 0.15 moli sono 0.15 x 58 = 8.7g.
Un litro di soluzione fisiologica contiene quindi 8.7 (circa 9) g/l di NaCl.
Sistema periodico degli elementi
Se si ordinano gli elementi secondo Z (= n° elettroni) crescente, si nota una periodicità delle proprietà chimiche, che dipende dalla conurazione elettronica (particolarmente degli elettroni più esterni). I gas nobili, con la loro struttura a ottetto elettronico periferico (massima stabilità) sono dei punti di interruzione tra un periodo e il successivo.
Gli elementi di una riga orizzontale formano i periodi, quelli incolonnati verticalmente costituiscono i gruppi. All'estremità destra della tavola periodica sono incolonnati i gas nobili, che segnano il confine tra un periodo e il successivo.
In relazione alle loro proprietà chimiche, gli elementi sono genericamente classificati in:
gas nobili (He, Ne, Ar, Kr, Xe, Rn): massima inerzia chimica
non-metalli (C, N, O, F, P, S, Cl, Se, Br, I): grande affinità per gli elettroni (elevata elettronegatività)
semi-metalli o elementi di transizione (B, Si, Ge, As, Sb, Te, Po, At): proprietà intermedie tra metalli e non-metalli
metalli (tutti gli altri elementi): fortemente elettropositivi (tendono a perdere elettroni)
L'elettronegatività diminuisce lungo un gruppo e aumenta lungo un periodo.
I metalli hanno caratteristiche fisico-chimiche comuni: lucentezza, compattezza, elevata conducibilità elettrica e termica, malleabilità, elettropositività, monoatomicità. Sono la grande maggioranza degli elementi.
I non-metalli sono caratterizzati da attributi negativi rispetto ai metalli: non malleabili, non splendenti, cattivi conduttori, elettronegativi, a molecola pluriatomica, fragili se solidi, ma spesso gassosi.
I semi-metalli hanno caratteristiche intermedie tra metalli e non-metalli.
I metalli combinandosi con l'ossigeno formano gli ossidi (es. ossido di sodio Na2O), che sciolti in acqua danno gli idrossidi (o basi) (es. idrossido di sodio NaOH), liberando OH- .
I non-metalli con l'ossigeno formano le anidridi (es. anidride carbonica CO2), che sciolte in acqua formano gli ossiacidi (es. acido carbonico H2CO3), liberando H+.
I metalli conbinandosi con l'idrogeno danno gli idruri (es. idruro di litio LiH), mentre i non-metalli danno idracidi (es. acido cloridrico HCl)
Idrossidi + acidi sale + acqua.
Nomenclatura in relazione al n° di ossidazione
Metallo + O2 ossido
NaO ossido di sodio
CaO ossido di calcio
Se il metallo ha 2 stati di ossidazione (valenze), desinenza "oso" per il n° di ossidazione minore e desinenza "ico" per il n° di ossidazione maggiore
es. FeO n° ossidazione Fe +2 ossido ferroso
Fe2O3 n° ossidazione Fe +3 ossido ferrico
Non-metallo + O2 anidride (desinenza "ica"; oppure "osa" e "ica" se 2 stati ox)
B2O3 anidride borica
CO2 anidride carbonica
Se il non-metallo possiede due stati di ossidazione, nomenclatura come per gli ossidi.
Es. SO2 n° ossidazione S +4 anidride solforosa
SO3 n° ossidazione S +6 anidride solforica
P2O3 n° ossidazione P +3 anidride fosforosa
P2O5 n° ossidazione P +5 anidride fosforica
Se il non-metallo possiede più di 2 stati di ossidazione:
es. cloro (+1, +3, +5, +7) anidride ipoclorosa, anidride clorosa, anidride clorica, anidride perclorica.
Ossido + acqua idrossido
Es. Na2O + H2O 2 NaOH idrossido di sodio
FeO + H2O Fe(OH)2 idrossido ferroso (n° ox +2)
Fe2O3 + H2O Fe(OH)3 idrossido ferrico (n° ox +3)
Anidride + acqua ossiacido
CO2 + H2O H2CO3 acido carbonico
SO2 + H2O H2SO3 acido solforoso (n° ox +4)
SO3 + H2O H2SO4 acido solforico (n° ox +6)
Se più di 2 stati di ossidazione, nomenclatura come anidridi.
Alcune anidridi possono reagire con più di una molecola d'acqua:
es. P2O5 + 1 H2O 2 HPO3 acido metafosforico
P2O5 + 2 H2O H4P2O7 acido pirofosforico
P2O5 + 3 H2O 2 H3PO4 acido ortofosforico
Idracidi (desinenza "idrico")
Es. HF acido fluoridrico
HCl acido cloridrico
Anioni degli acidi
Dissociandosi in acqua, gli acidi (sia gli ossiacidi che gli idracidi) perdono H+ e formano ioni aventi una o più cariche negative (anioni).
La desinenza "ico" dell'acido diventa "ato" dell'anione
La desinenza "oso" dell'acido diventa "ito" dell'anione
La desinenza "idrico" dell'acido diventa "uro" dell'anione
Es. HNO3 acido nitrico NO3- nitrato
H2SO3 acido solforoso SO32- nitrito
H2SO4 acido solforico SO42- solfato
HCl acido cloridrico Cl- cloruro
Ioni dei metalli
Nomenclatura come nel caso degli ossidi:
es. Ca2+ ione calcio
Fe2+ ione ferroso
Fe3+ ione ferrico
Sali
Formalmente derivano dalla reazione tra un acido e un idrossido (base) con la formazione di acqua. Il nome del sale deriva dal nome dell'anione dell'acido unito al nome del metallo.
Es. Na2SO4 solfato di sodio
NaCl cloruro di sodio
FeSO4 solfato ferroso
Fe2(SO4)3 solfato ferrino
Na3PO4 ortofosfato di sodio
Sali acidi
Quando non tutti gli idrogenioni dell'acido vengono salificati, si forma un sale "acido" che si dice "monoacido" se contiene ancora 1 idrogenione libero, "biacido" se ne contiene 2 e "triacido" se ne contiene 3.
Es. H2CO3 acido carbonico
Na2CO3 carbonato di sodio
NaHCO3 carbonato acido di sodio (o bicarbonato di sodio)
H3PO4 acido ortofosforico
Na3PO4 ortofosfato di sodio
Na2HPO4 ortofosfato monoacido di sodio
NaH2PO4 ortofosfato biacido di sodio
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta