| chimica |
|
|||||
|
|
|||||
|
CELLE GALVANICHE.
Nel paragrafo 12.2 abbiamo già introdotto l'aspetto qualitativo delle celle galvaniche per mostrare l'origine naturale del concetto di semi-reazione. Ora vogliamo discutere più in dettaglio le celle elettrochimiche per vedere come possono essere usate per dare un paragone quantitativo della forza degli agenti ossidanti e riducenti.
Si consideri allora la cella galvanica vista prima (detta pila Daniell), e si immaginino gli elettrodi connessi ai terminali di un voltmetro.
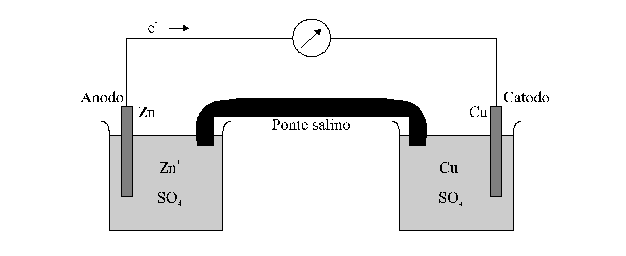
Si può mostrare sperimentalmente che, a temperatura costante, il voltaggio della cella è funzione del rapporto delle concentrazioni dello ione zinco e dello ione rame. Se la temperatura e 25°C e le concentrazioni degli ioni Zn2+ e Cu2+ sono uguali, il voltmetro legge 1,10 V. Se la concentrazione dello zinco viene aumentata, o quella del rame diminuita, il voltaggio diminuisce, e viceversa.
Si immagini ora che la semicella Cu/Cu2+ venga sostituita da una semicella contenente un filo d'argento immerso in una soluzione di nitrato di argento. Ancora una volta i dati sperimentali dimostrano che il voltaggio della cella dipende dal rapporto delle concentrazioni degli ioni e quando queste sono uguali il potenziale della cella è 1,56 V. Pertanto si vede che il voltaggio di una cella galvanica è caratteristico sia delle sostanze chimiche sia delle loro concentrazioni.
Per poter effettuare il paragone di diverse celle galvaniche, di ognuna bisogna misurare il voltaggio nelle stesse condizioni standard di concentrazione e temperatura.
Le condizioni standard scelte sono:
concentrazione 1 m (molalità) per tutte le sostanze;
pressione 1 atm per tutti i gas;
temperatura 25°C per i solidi.
Il voltaggio misurato in queste condizioni è detto potenziale normale (o standard) di cella ed è indicato con il simbolo DE°.
Il potenziale normale è una grandezza molto utile e importante:
I) In primo luogo, esso è in relazione con il lavoro che la cella galvanica può fare quando opera in condizioni standard, che è dato dal prodotto del voltaggio per la quantità di carica erogata. Quando una cella opera in condizioni standard, il suo voltaggio DE° dipende solo dalla natura chimica dei reagenti e dei prodotti. D'altro canto la quantità di carica che una cella può fornire dipende dalla quantità di sostanza disponibile per la reazione della cella. Pertanto tra i fattori che determinano la capacità di una cella elettrochimica a compiere lavoro, solo il DE° è direttamente legato alla natura chimica delle specie reagenti.
II) In secondo luogo, e come aspetto più importante, il potenziale di cella standard può essere considerato una misura quantitativa della tendenza dei reagenti nel loro stato standard a formare prodotti nel loro stato standard. In breve, DE° rappresenta la forza pilota (driving force) della reazione chimica. In particolare va sottolineato che la forza pilota della reazione per ogni altro stato dei reagenti e dei prodotti sarà in genere diversa da DE°. Sembra corretto considerare il potenziale di cella come una misura della driving force chimica della reazione, poiché quando la cella è in contrapposizione ad una forza elettromotrice superiore, la reazione spontanea di cella è invertita e avviene una elettrolisi.
Per quanto riguarda il segno di DE° è opportuno introdurre la convenzione che se una reazione procede spontaneamente da sinistra a destra, il DE° è positivo, se la direzione spontanea è da destra a sinistra, DE° assume segno negativo
Si può dire, dunque, che più positivo è il valore del DE°, maggiore è la tendenza della reazione a procedere da sinistra a destra.
Nel caso della cella rame-zinco, il valore di DE° può essere accettato come misura della tendenza dello zinco metallico a perdere elettroni e a dare ioni zinco e dello ione rame ad accettare elettroni e diventare rame metallico. In altre parole, DE° è una rappresentazione simultanea della forza dello zinco metallico come riducente e della capacità ossidante del rame. Così per poter are la forza di diversi ossidanti e riducenti sarebbe opportuno avere una misura della tendenza di una semi-reazione a procedere e, cioè, sarebbe utile avere i valori dei potenziali standard di semicella, piuttosto che i valori di DE°.
Il valore di DE° può essere considerato correttamente come la somma di due potenziali di semicella, ognuno associato con ciascuna delle semireazioni della cella. Ma poiché ogni cella galvanica coinvolge due reazioni, non è possibile misurare il valore assoluto del potenziale di una semicella, ma solo la somma algebrica di due valori. Di conseguenza, è possibile avere i valori numerici per i potenziali di semicella solo assegnando arbitrariamente il valore zero al potenziale di una semicella. Pertanto è stato deciso di dare alla semireazione idrogeno gas-ione idrogeno il valore zero quando i reagenti ed i prodotti sono negli stati standard:
![]()
Per assegnare il potenziale di semicella alle altre semi-reazioni, si misura il valore della forza elettromotrice relativa alla cella ottenuta accoppiando la semi-reazione in oggetto con la semicella ad idrogeno.
Quando la semicella zinco-zinco ione è accoppiata all'elettrodo standard a idrogeno, la misura della f.e.m. dà il valore 0,76 V e gli elettroni fluiscono dall'elettrodo a zinco a quello a idrogeno, mentre quanto la semicella rame-rame è accoppiata all'elettrodo ad idrogeno, la misura della f.e.m. dà 0,34 V e gli elettroni fluiscono dall'elettrodo a idrogeno al rame.
La direzione delle reazioni di cella spontanee è:
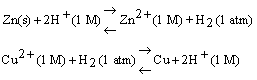
Questa informazione ci permette di dire che il valore assoluto del potenziale della coppia Zn-Zn2+ è 0,76 V e il valore assoluto del potenziale della coppia Cu-Cu2+ è 0,34 V. Per quanto riguarda, invece, il segno di tali potenziali, se si adotta la convenzione di scrivere le reazioni come riduzioni il valore e il segno del potenziale devono riflettere la tendenza relativa delle reazioni a procedere da sinistra a destra. Ora, gli esperimenti riportati in precedenza dicono che nella cella zinco-idrogeno riduce spontaneamente l'idrogeno ione. Pertanto il potenziale di semicella della reazione idrogeno ione-idrogeno deve essere più positivo di quello della reazione zinco ione-zinco, poiché quando le due reazioni vengono combinate la prima procede da sinistra a destra. Similmente gli esperimenti con la cella rame-idrogeno mostrano che lo ione rame è un ossidante migliore dello ione idrogeno o che la semireazione Cu2/Cu ha una tendenza più spiccata a procedere da sinistra a destra rispetto alla coppia H+/H2. Ne consegue che il potenziale della coppia Cu2+/Cu deve essere più positivo di quello della reazione ione-idrogeno.
Si ha pertanto:
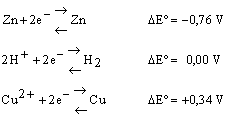
è da tenere presente che l'aumento del potenziale sta ad indicare una tendenza crescente per le semi-reazioni a procedere da sinistra a destra.
Si possono così riassumere le convenzioni concernenti i potenziali delle semicelle:
All'elettrodo standard a idrogeno si attribuisce il valore di potenziale di zero V (esatti).
Scrivendo tutte le semi-reazioni come riduzioni, le reazioni che procedono verso destra più facilmente di quanto si ha per la coppia H+/H2 avranno potenziale positivo, quello che manifestano una tendenza minore hanno un potenziale di semicella negativo.
Il valore (in senso algebrico) del potenziale di semicella è una misura quantitativa della tendenza di una reazione a procedere da sinistra a destra.
Se si inverte il verso di una semi-reazione si cambia il segno del potenziale. Se una semi-reazione è moltiplicata per un numero positivo, il potenziale resta invariato.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta