| chimica |
|
|||||
|
Composti inorganici: struttura e nomenclatura.
I rapporti di combinazione tra gli elementi dei composti (acidi o basici che siano) dipendono dal numero di legami che si formano e quindi dai numeri d'ossidazione in gioco.
(v. numero di ossidazione)
Sono un particolare tipo di legame chimico che si ha nel momento in cui gli elettroni di legame sono delocalizzati ovvero tutti gli elettroni gravitano attorno a tutti i nuclei, quindi non si possono distinguere gli elettroni di un singolo atomo. Proprio da questo deriva la bassissima elettronegatività dei metalli.
A seconda dell'altro reagente con cui il metallo reagisce, si ottengono composti dalle caratteristiche diverse.
IDRURI = METALLO + H (Idrogeno)
Si tratta di composti ottenuti da legami tra l'idrogeno e un metallo (o un semimetallo) e possono essere di tipo diverso a seconda dell'elemento con cui si legano:
_ idruri salini o ionici: se l'idrogeno si lega a metalli alcalini, ovvero gli elementi appartenenti al primo gruppo, prima colonna, della tavola periodica.
_ idruri metallici: se legati ai metalli di transizione (chiamati anche idruri binari dei metalli di transizione).
_ idruri complessi:
_ idruri covalenti: l'idrogeno forma legami di tipo covalente con i metalli dei gruppi IVB, VB, VIB e VIIB.
OSSIDI BASICI = METALLO + O (Ossigeno)
Gli ossidi basici sono composti binari ottenuti dalla combinazione dell'ossigeno con un metallo, in particolare con un elemento appartenente ai primi due gruppi del sistema periodico.
Sono caratterizzati da un legame ionico e sono generalmente solidi con una struttura cristallina.
Esempi e nomenclatura
Li O : Ossido di Litio
MgO : Ossido di Magnesio
FeO : Ossido di Ferro Ossido Ferroso
Fe O Triossido di Diferro Ossido Ferrico
(*) La nomenclatura ufficiale (IUPAC) prevede l'utilizzo di prefissi numerali davanti al nome degli elementi. Spesso però si ricorre alla vecchia nomenclatura che si affida ai suffissi (es. -oso, -ico) a seconda che il metallo (o non metallo) utilizzato abbia il maggiore o minore numero di ossidazione.
Se l'elemento che si combina con l'ossigeno non è classificabile né tra i metalli né tra i non metalli, è quindi un elemento di transizione appartenente alla "parte centrale" della tavola periodica (esclusi quelli dei primi spazi, che formano ossidi acidi, e degli ultimi spazi, che formano ossidi basici) o un semimetallo, gli ossidi che forma vengono definiti anfoteri, e hanno un duplice comportamento: sia acido, sia basico.
Esempi e nomenclatura:
Al O Triossido di Dialluminio
SnO : Ossido di Stagno Ossido Stannoso
Ossidi di tipo particolare sono anche i cosiddetti perossidi, i quali sono caratterizzati dalla presenza di due atomi di ossigeno legati fra loro, che perciò acquisiscono numero di ossidazione (-l) invece che (-2); necessariamente questa struttura chimica particolare conferisce a questi composti proprietà chimiche diverse da quelle degli ossidi normali.
Esempi e nomenclatura:
Na O Perossido di Sodio
K O : Perossido di Potassio
H O : Perossido di Idrogeno Acqua Ossigenata
IDROSSIDI = OSSIDO BASICO + H O (Acqua)
= METALLO + OH- (Ione Ossidrile o Ione Idrossido)
Mettendo un ossido basico in acqua si ha la formazione di un composto ternario definito idrossido, perché in realtà è come se nascesse direttamente dall'unione di ioni metallici con ioni idrossido o ossidrili, tanti quanto indicano i numeri di ossidazione dei metalli, sapendo che lo ione ossidrile ha numero di ossidazione (-l). Anche gli idrossidi sono basati su legami ionici.
Esempi e nomenclatura:
FeO + H O à Fe(OH)
(Fe+) + 2(OH-) à Fe(OH) Idrossido Ferroso
Fe O + 3H O à 2Fe(OH)
(Fe+) + 3(OH-) à Fe(OH) Idrossido Ferrico
Se un idrossido viene sciolto in acqua la sua struttura cristallina viene smantellata ed in soluzione si avranno ioni metallici positivi e ioni OH- negativi (grazie a una reazione di dissociazione ionica), entrambi allo stato libero.
Esempi:
NaOH à (Na+) + (OH-)
Ca(OH) à (Ca2+) + 2(OH-)
IDRACIDI = NON METALLO + H (Idrogeno)
Sono sostanze che si comportano come acidi, ossia in soluzione acquosa liberano ioni H+ e sono sostanzialmente ottenute per combinazione diretta dell'idrogeno con un non metallo del VII gruppo o con lo zolfo (S).
Questi composti contengono tutti un legame covalente molto polarizzato il quale a contatto con l'acqua si scinde liberando ioni H+ e ioni negativi (Es.: Cl-).
Esempi e nomenclatura:
HF : Fluoruro di Idrogeno Acido Fluoridrico
HCl : Cloruro di Idrogeno Acido Cloridrico
H S : Solfuro di Idrogeno Acido Solfidrico
La desinenza -uro si applica ufficialmente a tutti i composti binari ad eccezione degli ossidi. Per analogia però essa viene usata anche per idracidi non binari:
Esempi:
HCN : Cianuro di Idrogeno Acido Cianidrico
OSSIDI ACIDI (ANIDRIDI) = NON METALLO + O (Ossigeno)
Gli ossidi acidi sono quelli formati dai non metalli (degli ultimi gruppi) legati all'ossigeno, e sono caratterizzati da legami covalenti, hanno quindi struttura molecolare e sono per lo più allo stato gassoso.
Esempi e nomenclatura:
SO Diossido di Zolfo Anidride Solforosa
Cl O : Eptossido di Dicloro Anidride Perclorica
N O : Pentossido di Diazoto Anidride Nitrica
C O : Diossido di Carbonio Anidride Carbonica
OSSIACIDI = NON METALLO + H O (Acqua)
Hanno la stessa struttura fondamentale degli idrossidi solo che un non metallo sostituisce il metallo.
I non metalli danno quasi sempre origine a strutture miste nelle quali, oltre a uno o più gruppi ossidrilici (OH), compaiono anche atomi di ossigeno legati direttamente al non metallo, a differenza degli idrossidi in cui questo non avveniva.
Per distinguere gli ossiacidi dagli idrossidi, le loro formule (brute e non di struttura, in cui si metterebbero in evidenza anche i legami) si scrivono in maniera differente, ponendo nell'ordine prima l'idrogeno, poi il non metallo e infine l'ossigeno.
Esempi e nomenclatura:
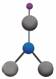 HNO : Acido
Nitrico
HNO : Acido
Nitrico
H SO : Acido Solforico Formula di struttura dell'Acido Nitrico
H PO4 Acido Fosforico
Anche in questo caso si hanno composti intermedi o "anfoteri" che possono essere considerati sia idrossidi sia ossiacidi.
Il legame O - H (che abbiamo visto è caratteristico sia di idrossidi che di ossiacidi) è un legame covalente nel quale l'ossigeno, essendo l'elemento più elettronegativo, attira verso di sé la carica elettronica. Risulta così un legame polarizzato negativamente in direzione dell'ossigeno.
Se ora l'ossigeno si lega con un non metallo, il legame che si forma è di tipo covalente nel quale l'ossigeno impegna una parte della sua carica negativa. Ciò provoca uno spostamento in senso inverso della carica nel legame O - H il quale aumenterà la sua polarizzazione, e quindi accentuerà il suo carattere parzialmente ionico, tanto più quanto maggiore è l'elettronegatività del non metallo.
Nel caso invece di un legame tra O - H e un metallo, esso è un legame ionico in cui l'ossigeno aumenta la sua carica negativa che viene respinta in direzione dell'idrogeno. In tal modo la polarità del legame Metallo - O - H diminuisce e si rafforza il suo carattere covalente.
Tutto ciò non avrebbe una grande importanza se non si verificasse una circostanza particolare: quando questi composti vengono disciolti in acqua, il legame ionico degli idrossidi e quello parzialmente ionico degli ossiacidi si rompono.
Se un ossiacido viene sciolto in acqua, vanno in soluzione ioni H+ positivi e ioni negativi costituiti dalla parte rimanente della molecola.
Nel caso degli idrossidi vengono invece liberati ioni OH-.
La differenza tra i due tipi di composti è tutta qui, ma in realtà è di importanza fondamentale perché da origine a comportamenti assai diversi: determina l'acidità dei primi e la basicità dei secondi.
Esempi:
HNO3 à (H+) + (NO3-)
H2SO4 à (H+) + (SO4-)
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta