| chimica |
|
DA BOYLE A LAVOISIER: LE BASI DELLA SCIENZA CHIMICA
ELEMENTO: ogni sostanza che non può essere scomposta in sostanze più semplici per mezzo di operazioni chimiche.
A metà '600 fu sviluppata la teoria del flogisto, secondo la quale ogni corpo, vegetale o animale, contiene flogisto; nel momento della combustione questo viene liberato dal corpo e raccolta dall'aria che lo passa ad altri corpi che così diventano a loro volta combustibili. Solo con Lavoisier e lo studio dell'aria si scoprì l'ossigeno e venne liquidata la teoria del flogisto.
LEGGE DI CONSERVAZIONE DELLA MASSA: enunciata nel 1789 da Lavoisier: in una reazione chimica la massa totale delle sostanze reagenti è uguale alla massa delle sostanze prodotte; la massa di ogni elemento presente nella sostanza iniziale è uguale a quello nella sostanza finale.
CONSEGUENZE LEGGE
Atomi indivisibili
Gli atomi non si possono trasformare gli uni negli altri
LEGGI DEI RAPPORTI PONDERALI
LEGGE DELLE PROPORZIONI DEFINITE E COSTANTI o LEGGE DI PROUST: 1799, in un composto chimico puro, gli elementi costituenti sono sempre presenti in rapporti di peso definiti e costanti.
LEGGE DELLE PROPORZIONI MULTIPLE o LEGGE DI DALTON: 1803, quando due elementi si combinano tra di loro per formare due o più composti i rapporti tra le quantità di peso di uno stesso elemento combinato con una quantità fissa dell'altro sono espressi da numeri interi, generalmente piccoli.
TEORIA ATOMICA DI DALTON
ATOMO COMPOSTO: combinazione di atomi di elementi differenti. Il peso degli atomi composti si trova facendo la somma del peso di ogni atomo elementare che lo compone.
La materia è costituita da particelle piccolissime e indivisibili chiamate atomi
Gli atomi di uno stesso elemento hanno stesso peso e stessa massa, atomi differenti si possono combinare tra loro e le combinazioni avvengono fra atomi interi non tra frazioni di atomi.
In una combinazione chimica gli atomi mantengono la propria identità e non vengono distrutti.
PESO ATOMICO RELATIVO: il numero che esprime il rapporto fra la massa dell'atomo di quell'elemento e quella dell'atomo d'idrogeno.
MASSA ATOMICA RELATIVA e MASSA MOLECOLARE RELATIVA
UNITÀ DI RIFERIMENTO: uma 12 parte del carbonio 12
UMA: 1.66x10ˉ²
MASSA ATOMICA RELATIVA: rapporto tra la massa dell'atomo dell'elemento e l'uma.
MASSA MOLECOLARE RELATIVA: somma delle masse atomiche relative degli elementi componenti una molecola.
NATURA ELETTRICA DELLA MATERIA
Le forze responsabili dell'interazione chimica sono di natura elettrica.
L'atomo non è indivisibile; è formato da una composizione di particelle con carica positiva (protoni) e negativa (elettroni).
Un corpo è elettricamente carico se, sottoposto a uno strofinio, attira altri corpi di piccole dimensioni.
Esistono due tipi di carica elettrica: positiva e negativa
Cariche di segno uguale si respingono, cariche di segno opposto si attirano.
Cationi: ioni positivi
Anioni: ioni negativi
Le cariche elettriche si attraggono se opposte e si respingono se uguali
Le cariche elettriche possono passare da un corpo a un altro
Un corpo è elettricamente neutro se possiede uno stesso numero di cariche positive e negative.
PARTICELLE SUBATOMICHE: ELETTRONI E PROTONE
Per arrivare alla scoperta di elettroni e protoni si utilizzarono tubi a vuoto sottoposti al passaggio di corrente elettrica.
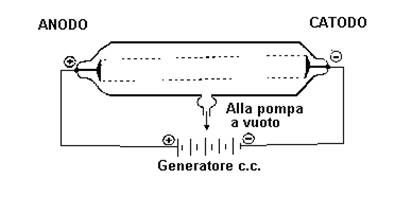
TUBO DI CROOKES: tubo ottenuto perfezionando un modello già esistente. È costituito da un tubo di vetro molto resistente alle cui estremità sono collocati due elettrodi che sono collegati ad un polo negativo (catodo) e a uno positivo (anodo) di un generatore di corrente; inoltre, attraverso un condotto laterale viene collegato ad una pompa per praticare il vuoto provocato da una riduzione della pressione interna. Questo tubo può contenere aria oppure gas specifici.
Applicando una forte differenza di potenziale tra gli elettrodi e riducendo la pressione del gas contenuto, osservò che si verificava l'emissione di raggi luminosi, ma iva, anche una fluorescenza verdastra sull'estremità opposta al catodo. Queste radiazioni provenienti dal catodo furono nominate raggi catodici; essi avevano particolari proprietà:
Hanno natura corpuscolare, perché, se si pone un mulinello sulla loro traiettoria esso si muoverà;
Hanno traiettoria rettilinea, ponendo un oggetto sulla loro traiettoria l'ombra verrà proiettata in una linea retta,
La traiettoria dei raggi può essere modificata dall'azione di campi magnetici o elettrici, essi sono costituiti di particelle con carica elettrica.
Si scoprì così che i raggi catodici erano formati da particelle dotate di carica negativa presenti negli atomi di tutti gli elementi. Dopo aver calcolato la massa dell'elettrone si scoprì che era circa 2000 volte più piccolo dello ione di H il quale era stata fino ad allora considerato la particella minima di materia, a questo punto si verificò l'infondatezza di quest'affermazione.
ELETTRONE: particella unitaria di carica negativa.
Goldstein, utilizzò un tubo molto simile a quello di Crookes, il quale aveva un catodo munito di minuscoli fori, scoprì una radiazione carica positivamente che attraversava i fori e si dirigeva in direzione opposta a quella dell'anodo producendo una debole luminosità sullo schermo rivelatore. Anni dopo si scoprì che questi raggi avevano massa maggiore agli elettroni, e la loro massa cambiava in base al gas utilizzato.
Rutherford scoprì che la maggior parte della massa dell'atomo era concentrata in un nucleo centrale carico positivamente.
La massa dei protoni è circa 1800 volte quella degli elettroni.
PROTONE: particella unitaria di carica positiva.
MODELLO ATOMICO DI THOMSON E RUTHERFORD
ATOMO DI THOMSON: sfera carica di elettricità positiva al cui interno sono immersi gli elettroni.
MODELLO ATOMICO DI THOMSON
Ioni positivi: atomi che hanno perduto elettroni
Ioni negativi: atomi che hanno acquistato elettroni
MODELLO ATOMICO DI RUTHERFORD: per acquistare informazioni più dettagliate sulla reale distribuzioni degli elettroni sugli atomi, Rutherford usò:
Una lamina d'oro;
Circondata da uno schermo fluorescente
Una sorgente radioattiva dalla quale partivano raggi α
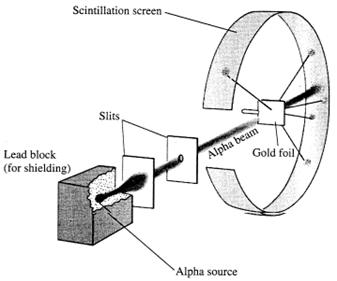
I raggi alfa colpivano la lamina d'oro, lo schermo fluorescente se colpito da particelle alfa produceva un punto luminoso in modo da poter vedere la traiettoria.
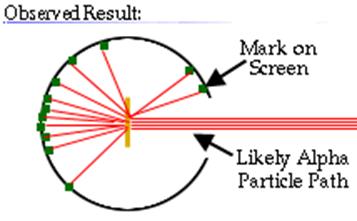
A questo punto seguendo il modello atomico di Thomson si pensava che le particelle avrebbero passato la lamina senza apprezzabili deviazioni, ma così non fu. Si notò che la maggior parte delle particelle non subiva deviazioni importanti ma altre venivano deviate o addirittura respinte.
Così si capì che l'atomo aveva un nucleo dotato di carica positiva, dove risiedeva la maggior parte della massa e gli elettroni dovevano trovarsi nello spazio circostante. Quindi lo spazio racchiuso dall'atomo era prevalentemente vuoto: la maggior parte delle particelle passavano indisturbate questo spazio vuoto mentre quando entravano direttamente in collisione con i nuclei venivano respinti o deviati.
NUMERO ATOMICO, NUMERO DI MASSA, ISOTOPI
Si notò che il valore della massa di un atomo era maggiore alla somma della massa di protoni ed elettroni quindi s'ipotizzò esistesse una terza specie di particelle subatomiche che avessero carica neutra. Colpirono una lamina di berillio con particelle alfa e si vide un'emissione di particelle che non venivano deviate da campi elettrici o magnetici così si nominarono NEUTRONI.
La massa del neutrone è quasi pari a quella dell'elettrone.
Solo da quel momento si poté dare una descrizione completa della struttura dell'atomo:
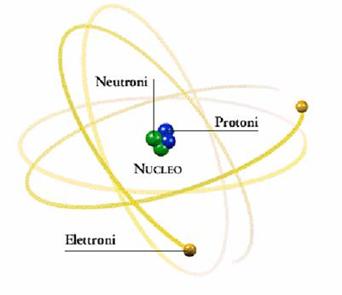
Diviso in nucleo e intorno ad esso si dispongono gli elettroni
Nucleo composto da protoni (positivi) e neutroni (carica neutra)
Elettroni di carica negativa
In un atomo il numero degli elettroni è pari a quello dei protoni
NUMERO ATOMICO: è il numero di protoni presenti nel nucleo di un atomo (Z).
In un atomo elettricamente neutro il numero atomico indica anche il numero degli elettroni.
NUMERO DI MASSA: è la somma tra numero di protoni e neutroni (A).
ISOTOPI: atomi di un medesimo elemento che possiedono lo stesso numero atomico ma diverso numero di massa.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta