| chimica |
|
DALLE VELOCITà DI REAZIONE ALL'EQUAZIONE CHE REGOLA LE CONDIZIONI DI EQUILIBRIO: LA LEGGE DI AZIONE DI MASSA.
Si consideri un recipiente di volume V che contenga idrogeno e iodio alla temperatura T. Queste due sostanze tenderanno a reagire secondo il verso 1 della reazione
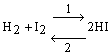
per portare il sistema in uno stato di minore energia, essendo il contenuto termico (entalpia) dell'acido iodidrico minore di quello di idrogeno e iodio.
L'acido iodidrico che si forma tenderà a sua volta a decomporsi secondo il verso 2 della reazione per portare il sistema in uno stato di maggior disordine, essendo il grado di disordine (entropia) di idrogeno e iodio maggiore di quello dell'acido iodidrico.
|
|
Le velocità della reazione nei due versi saranno espresse dalle seguenti equazioni cinetiche:
![]()
avendo indicato con le parentesi quadre le concentrazioni molari.
Col procedere della reazione le concentrazioni di idrogeno e iodio andranno diminuendo e quella di acido iodidrico aumentando. Ne segue che le velocità v1 e v2 andranno, nel tempo, rispettivamente diminuendo ed aumentando fino a diventare uguali, secondo lo schema qui a lato, ed il sistema è in equilibrio.
In queste condizioni si ha:
![]()
da cui:
![]()
Questa equazione prende il nome di legge dell'azione di massa, la costante K il nome di costante di equilibrio e le concentrazioni che soddisfano questa equazione il nome di concentrazioni all'equilibrio.
La medesima trattazione può essere estesa anche a reazioni che procedono in più stadi. Si consideri ad esempio la reazione:
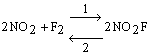
che sappiamo avvenire in due stadi:
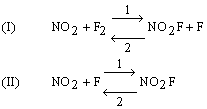
La condizione di equilibrio in questo sistema è che ogni stadio ed il suo inverso abbiano la stessa velocità:
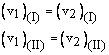
cioè:
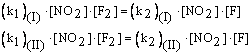
Moltiplicando tra loro i primi membri ed i secondi membri delle due equazioni e semplificando si avrà:
![]()
da cui:

cioè gli esponenti cui vanno elevate le concentrazioni che compaiono nella legge dell'azione di massa coincidono sempre con i coefficienti di reazione, indipendentemente se la reazione avviene in uno o più stadi.
In generale, per una generica reazione
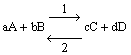
la legge di azione di massa è espressa da:
![]()
dove K rimane rigorosamente costante al variare delle attività di A, B, C e D, e dipende solo dalla natura di queste sostanze e dalla temperatura.
È da notare che, poiché le concentrazioni delle sostanze pure allo stato condensato, essendo costanti a temperatura costante, non compaiono nelle equazioni cinetiche, non iranno nemmeno nella legge dell'azione di massa.
Ad esempio, per la reazione

la legge dell'azione di massa sarà espressa da:
![]()
Per le sostanze gassose può essere alle volte utile sostituire, nella legge dell'azione di massa, alle concentrazioni molari le rispettive pressioni parziali. In particolare, essendo pi=ci R T, se tutte e quattro le sostanze della reazione sono allo stato gassoso, si ha:
![]()
dove Dn=c+d-(a+b) rappresenta la differenza fra il numero di moli dei prodotti e quello dei reagenti. È evidente che se il numero di moli a sinistra e a destra della reazione è uguale, si ha Dn=0 e Kp=K. Inoltre va ricordato che le sostanze pure allo stato condensato non influiscono sul Dn.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta