| chimica |
|
Determinazione della costante di dissociazione di un elettrolita debole con metodo conduttimetrico
Introduzione teorica
Questa esperienza è volta alla determinazione della costante di dissociazione dell'acido acetico, tramite un metodo elettrochimico, in specifico quello conduttimetrico.
Quando si analizza una soluzione dal punto di vista elettrochimico è importante conoscere la resistenza R (espressa in W) di questa rispetto al passaggio della corrente, o la conduttanza G (misurata in S), ovvero R-l. Entrambe sono collegate ad un'altra proprietà, la conducibilità specifica, tramite la seguente formula:
![]()
Il rapporto L/S è denominato costante di cella; dal punto di vista teorico si potrebbe calcolare misurando la distanza tra gli elettrodi e la loro superficie attiva. Le celle, però, sono dell'ordine di pochi millimetri, risulta perciò quasi impossibile trovare empiricamente questo valore, che viene calcolato misurando la resistenza (o la conduttanza) di una soluzione di molarità nota e conducibilità tabulata ad una certa temperatura.
La conducibilità specifica k misurata in W-l cm-l, rappresenta la capacità di trasporto di carica da parte della soluzione elettrolitica, varia a seconda del solvente e può essere a sua volta rappresentata dall'equazione:
k = F z n a c (u+ + u
dove F è la costante di Faraday (
Si introduce, poi, una conducibilità che
non sia legata alla concentrazione esplicitamente, chiamata
conducibilità molare L ( misurata
in W-l cm2 mol-l), uguale a k/c, che rappresenta la carica trasportata in 1 secondo da una soluzione contenente
1 mole di soluto tra due piani distanti
![]()
Si può, infatti, vedere questa equazione come una dipendenza lineare tra L-l e cL, in modo da ottenere una retta che ha come intercetta L°-l da cui si calcola il valore della conducibilità molare a diluizione infinita.
Questa procedura è esattamente quella che ci porterà, nell'esperienza, a trovare poi, tramite il coefficiente angolare, il valore sperimentare della costante di dissociazione dell'acido acetico.
Va, inoltre, ricordato che la legge sopraccitata è una rielaborazione dell'espressione della costante di dissociazione espressa tramite la concentrazione e il grado di dissociazione dell'analita:
Ka=
![]()
![]()
![]() con a L L
con a L L
![]()
![]()
Per tutto ciò che riguarda le costanti di equilibrio e, in particolare, la costante di dissociazione di un acido debole, si veda l'Introduzione teorica della relazione circa la determinazione della costante di dissociazione del verde di bromocresolo (VBC).
Svolgimento
Prima di iniziare l'esperienza si verifica che
la conducibilità, misurata in acqua milli-Q, non superi 1-2mS; si carica poi il
reattore con 120 ml di soluzione 5 × 10-
Si parte, appunto, da una soluzione 5 × 10-
Ciò che si legge dal conduttimetro è, appunto, la conduttanza G, il reciproco della resistenza R, pertanto, prima di poter procedere con l'applicazione della legge di Kraus e Bray, bisogna calcolare la costante di cella.
Questa misura è piuttosto rapida; dopo
aver lavato accuratamente il reattore, vi si pone all'interno una soluzione KCl
Quest'ultima ci serve per trasformare tutte le conduttanze prima registrate in conducibilità, le quali a loro volta verranno divise per le rispettive concentrazioni in modo da ottenere la conducibilità molare L.
Ponendo in grafico il prodotto conducibilità molare e concentrazione, con il ripettivo della conducibilit à molare stessa, otteniamo una retta. Quest'ultima ci fornisce dall'intercetta la conducibilità molare a diluizione infinita L° e, poi, dal coefficiente angolare, la costante di dissociazione dell'acido acetico che stavamo appunto cercando.
Calcoli, tabelle e grafici
Preparazione soluzione di partenza
5 10-
A noi viene consegnata una soluzione madre
Volume madre=![]()
Il volume da prelevare dalla soluzione madre è, quindi, abbastanza per non commettere grossi errori.
Calcolo delle concentrazioni dopo l'aggiunta di soluzione madre
Ci è stata consegnato un range di
concentrazione da 5*10-
![]()
Per ottenere il range di concentrazioni desiderate abbiamo compiuto ventitre aggiunte da 1ml, fino ad avere una concentrazione di 2,03*10-3.
Calcolo della costante di cella
Una volta ottenuto dal conduttimetro il valore della conduttanza del KCl 0,1m inserito nella cella, si può calcolare l'inverso della costante di cella e,quindi, la costante di cella stessa.
I valori di conducibilità specifica del cloruro di potassio sono tabulati per determinate temperature, se la misura viene effettuata ad una valore non contenuto tra quelli schedati, si deve interpolare, mediante una polinomiale prestabilita, la temperatura più vicina a quella empirica per ottenere il valore di k
La temperatura rilevata dalla nostra sonda era
esattamente
I calcoli effettuati sono:
![]()
G =![]() k
k
![]() =
= ![]() e
e ![]()
Da cui si ricava la costante di cella.
I nostri valori sono:
T= 298,15 K k W-lm-l G= 11865 mS
pertanto ![]() =1,081m-l
=1,081m-l
Considerando che i valori delle costanti di cella si aggirano, normalmente, intorno a 1,00m-l, il valore sperimentale è accettabile.
Calcolo di L° e Ka per l'acido acetico
La tabella sotto riportata contiene tutti i dati relativi alle concentrazioni della soluzione nel reattore dopo ogni aggiunta di acido acetico alla soluzione iniziale, sia in mol/dm3, sia in mol/cm3, e la conduttanza rilevata sperimentalmente:
|
ml |
moli |
c/(mol dm-3) |
c /(mol cm-3) |
G(mS) |
|
|
6,00E-05 |
5,00E-04 |
5,00E-07 |
3,67E+01 |
|
|
7,00E-05 |
5,79E-04 |
5,79E-07 |
3,96E+01 |
|
|
8,00E-05 |
6,56E-04 |
6,56E-07 |
4,23E+01 |
|
|
9,00E-05 |
7,32E-04 |
7,32E-07 |
4,48E+01 |
|
|
1,00E-04 |
8,06E-04 |
8,06E-07 |
4,71E+01 |
|
|
1,10E-04 |
8,80E-04 |
8,80E-07 |
4,91E+01 |
|
|
1,20E-04 |
9,52E-04 |
9,52E-07 |
5,12E+01 |
|
|
1,30E-04 |
1,02E-03 |
1,02E-06 |
5,31E+01 |
|
|
1,40E-04 |
1,09E-03 |
1,09E-06 |
5,49E+01 |
|
|
1,50E-04 |
1,16E-03 |
1,16E-06 |
5,67E+01 |
|
|
1,60E-04 |
1,23E-03 |
1,23E-06 |
5,84E+01 |
|
|
1,70E-04 |
1,30E-03 |
1,30E-06 |
6,00E+01 |
|
|
1,80E-04 |
1,36E-03 |
1,36E-06 |
6,14E+01 |
|
|
1,90E-04 |
1,43E-03 |
1,43E-06 |
6,28E+01 |
|
|
2,00E-04 |
1,49E-03 |
1,49E-06 |
6,43E+01 |
|
|
2,10E-04 |
1,56E-03 |
1,56E-06 |
6,57E+01 |
|
|
2,20E-04 |
1,62E-03 |
1,62E-06 |
6,70E+01 |
|
|
2,30E-04 |
1,68E-03 |
1,68E-06 |
6,83E+01 |
|
|
2,40E-04 |
1,74E-03 |
1,74E-06 |
6,96E+01 |
|
|
2,50E-04 |
1,80E-03 |
1,80E-06 |
7,08E+01 |
|
|
2,60E-04 |
1,86E-03 |
1,86E-06 |
7,20E+01 |
|
|
2,70E-04 |
1,91E-03 |
1,91E-06 |
7,31E+01 |
|
|
2,80E-04 |
1,97E-03 |
1,97E-06 |
7,43E+01 |
|
|
2,90E-04 |
2,03E-03 |
2,03E-06 |
7,53E+01 |
Una volta ottenuti tutti i valori di G, si calcolano prima la conducibilità specifica, poi quella molare e, infine, L-l e cL che sono necessarie per costruire il grafico relativo alla formula di Kraus e Bray.
Calcoliamo k da G mediante la formula :
k = ![]()
E quindi L dalla sua
definizione: L = ![]()
Nella tabella qui sotto viene completata la serie di dati necessari alla costruzione del grafico, calcolando i valori sperimentali cL e L-l , questi ultimi sono i dati inseriti successivamente nel grafico.
|
k/(mS cm-l |
L/ S cm2mol-l |
cL S cm2 l-l |
L-l (S-l cm-2 mol) |
|
3,39E+01 |
|
|
1,4746E-02 |
|
3,66E+01 |
|
|
1,5786E-02 |
|
3,91E+01 |
|
|
1,6752E-02 |
|
4,14E+01 |
|
|
1,7654E-02 |
|
4,36E+01 |
|
|
1,8503E-02 |
|
4,55E+01 |
|
|
1,9356E-02 |
|
4,74E+01 |
|
|
2,0090E-02 |
|
4,91E+01 |
|
|
2,0852E-02 |
|
5,08E+01 |
|
|
2,1518E-02 |
|
5,25E+01 |
|
|
2,2159E-02 |
|
5,40E+01 |
|
|
2,2795E-02 |
|
5,55E+01 |
|
|
2,3397E-02 |
|
5,68E+01 |
|
|
2,4009E-02 |
|
5,81E+01 |
|
|
2,4596E-02 |
|
5,94E+01 |
|
|
2,5109E-02 |
|
6,08E+01 |
|
|
2,5603E-02 |
|
6,20E+01 |
|
|
2,6097E-02 |
|
6,32E+01 |
|
|
2,6560E-02 |
|
6,44E+01 |
|
|
2,7008E-02 |
|
6,55E+01 |
|
|
2,7450E-02 |
|
6,66E+01 |
|
|
2,7895E-02 |
|
6,76E+01 |
|
|
2,8306E-02 |
|
6,87E+01 |
|
|
2,8701E-02 |
|
6,97E+01 |
|
|
2,9106E-02 |
Il grafico prodotto dall'utilizzo dei dati nelle colonne colorate in tabella è:
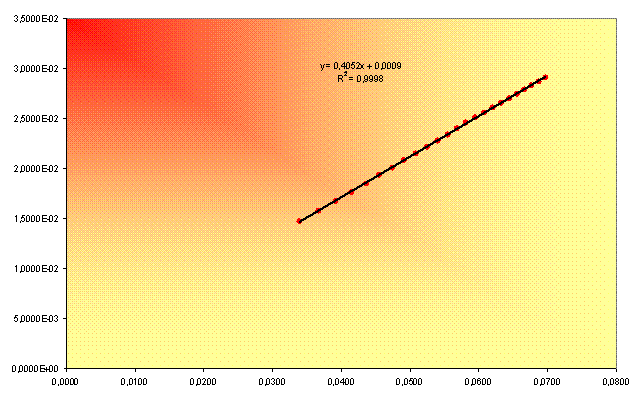
Dai valori dell'intercetta (9*10-4) e del coefficiente angolare (0.4052) di questa retta, si ricavano, rispettivamente, L° e Ka. Dalla legge di Kraus e Bray, infatti, è possibile rappresentare il valore dell'intercetta come L°-l e quello del coefficiente angolare come (Ka* L°2)-l .
Equazione di Kraus e Bray:
![]()
Formula dell'intercetta:
![]()
Calcolo della conducibilità molare a diluizione infinita sperimentale:
![]() W-l cm2
mol-l
W-l cm2
mol-l
Formula del coefficiente angolare:
![]()
Calcolo della costante di dissociazione sperimentale:
![]()
Calcolo della pKa sperimentale:
pKa = - Log (Ka) = - Log (1.9990*10-6) = 5.6992
I valori
della Ka e della L° che abbiamo trovato vanno ora confrontati con i valori tabulati,
ritenuti esatti. Alla temperatura di
L W-l cm2 mol-l
pKa = 4.7560
quindi
Ka = 10(-pKa) = 10(-4.7560) = 1.7539*10-5
Calcolo degli errori
Proponiamo ora una valutazione degli errori percentuali commessi rispetto ai valori tabulati.
Se avessimo ottenuto i giusti valori di L° e Ka avremmo avuto un'intercetta uguale a:
y = mx + q
q= ![]() =
(391,5)-l= 2,55*10-3
=
(391,5)-l= 2,55*10-3
e un coefficiente angolare di valore:
m=![]() 0,3720
0,3720
Pertanto, l'errore percentuale valutato sulla pendenza è:
epend=![]() 8,92%
8,92%
L'errore percentuale valutato sull'intercetta è:
eint=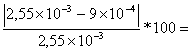 64,7%
64,7%
Calcoliamo ora gli errori percentuali dei valori sperimentali di L°, Ka e pKa rispetto a quelli tabulati. La formula utilizzata in entrambi i casi è:
e =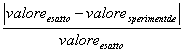 *100
*100
da cui deriva che:
e L eKa epKa
Proviamo ora ad utilizzare il valore tabulato di L° (dato che il nostro dato è affetto da un grande errore) per calcolare la costante di dissociazione e vediamo la variazione degli errori su quest'ultima.
Ka=![]() =1,6105*10-5
=1,6105*10-5
pKa= -Log(1,6105*10-5)=4,7930
ricalcoliamo ora gli errori mediante la formula esplicitata prima:
eKa epKa
Come è evidente gli errori si abbassano notevolemente, quindi è ragionevole pensare che l'errore più incisivo sia stato commesso su di L
Conclusioni teoriche
La retta ottenuta sperimentalmente ha un buon valore di R2 (0,9998), il che mostra la mancanza di grossi errori casuali nella procedura. I punti ottenuti seguono con buona approssimazione la legge d Kraus e Bray, quindi non abbiamo raccolti valori nell'area in cui la dipendenza comincia a scostarsi da quella teorica e il grafico si avvicina ad una parabola. La concentrazione di partenza, pur essendo piuttosto bassa, non ha reso imprecise le misure, infatti i valori sono ben allineati e il conduttimetro è sempre stato stabile fin dalla prima rilevazione.
La conducibilità molare sperimentale è, però, fortemente diversa da quella tabulata. Abbiamo ottenuto un dato di L°=1111 S cm2 mol-l, contro il valore "corretto" di L 391.5 S cm2 mol-l, che equivale ad un errore di 183,80%. Del resto questo valore deriva da un'intercetta sperimentale, che, se non rilevata esattamente evitando la carbonatazione delle soluzioni e utilizzando molti punti a basse concentrazioni, può portare a grossi errori. La nostra intercetta vale 9*10-4, ma avrebbe dovuto essere 2,55*10-3, ci sono, quindi, quasi due ordini di grandezza di differenza. Queste considerazioni portano a ritenere che ci sia stato un errore sistematico. Inoltre, dover lavorare a valori così bassi ha, probabilmente, aumentato notevolmente l'errore commesso per eventuali piccoli errori casuali e imprecisioni.
Calcolando la costante di dissociazione mediante la L° sperimentale otteniamo un valore di Ka=1,9990*10-6, che è al di sotto di un ordine rispetto al valore tabulato, Ka=1,7560*10-5, l'errore risulta 88,60%; la pKa calcolata partendo da questo valore è 5,6992, contro un valore esatto di 4,7560 per un errore del 19,83%. Questi dati evidenziano, nuovamente, la presenza di un errore sistematico.
Se,invece, calcoliamo
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta