| chimica |
|
|||||
|
ELETTROLISI E LEGGI DI FARADAY.
|
|
Sinora sono state considerate esclusivamente situazioni in cui le reazioni spontanee che avvengono in una cella costituiscono una fonte di differenza di potenziale e di corrente elettrica (celle galvaniche). Il caso opposto è costituito dalla elettrolisi, in cui una fonte di differenza di potenziale esterna è usata per causare una variazione in un sistema chimico. Queste celle sono dette celle elettrolitiche.
La possibilità da parte di una soluzione elettrolitica di condurre corrente elettrica è dovuta alla presenza in soluzione di ioni positivi e negativi che hanno la funzione di trasportatori di cariche. Se immergiamo, quindi, in una soluzione elettrolitica due lamine metalliche, dette elettrodi, collegate all'esterno con una sorgente di forza elettromotrice (f.e.m.), avremo passaggio di corrente attraverso la soluzione accomnato da fenomeni chimici agli elettrodi. L'elettrodo collegato al polo positivo della sorgente esterna di f.e.m. viene indicato come anodo, mentre con nome di catodo si indica l'altro elettrodo collegato col polo negativo. Sotto la spinta della f.e.m. esterna gli ioni carichi positivamente, cationi, si muovono verso l'elettrodo negativo o catodo, mentre gli ioni negativi, anioni, si muovono verso l'elettrodo positivo o anodo. Nel circuito metallico esterno si muovono elettroni.
All'interfaccia tra catodo e soluzione, gli elettroni in arrivo vengono assorbiti nel processo di scarica di un catione Mn+ secondo lo schema
![]()
in una qualsiasi altra reazione di riduzione che assorba elettroni, come ad esempio
![]()
Contemporaneamente all'anodo può avvenire la scarica di un anione del tipo Xn- secondo la reazione
![]()
ovvero il passaggio in soluzione di atomi dell'elettrodo, se esso è costituito da materiale attaccabile, secondo la reazione inversa
![]()
una qualsiasi altra reazione di ossidazione che porti a cessione di elettroni, come ad esempio
![]()
Gli elettrodi che si liberano all'anodo vengono spinti dalla f.e.m. esterna verso il catodo, determinando passaggio di elettroni nel circuito esterno. Gli ioni funzionano da trasportatori di cariche nella soluzione, chiudendo il circuito esterno e facendo così circolare la corrente elettrica.
|
|
Forse il processo elettrolitico più semplice si realizza quando due lamine di rame, connesse ad una fonte di differenza di potenziale (generatore di tensione V), vengono immerse in una soluzione acquosa di solfato di rame. Una corrente passa e sulla lamina connessa la polo negativo si deposita rame, mentre all'altro elettrodo il rame viene ossidato a ione Cu2+. L'elettrodo ove avviene la riduzione è detto sempre catodo, mentre l'anodo è sempre l'elettrodo che è sede di processi di ossidazione.
Si ha:
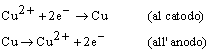
Poiché la decomposizione elettrolitica è determinata dal passaggio di corrente in soluzione, è logico attendersi che il grado di avanzamento dei processi chimici agli elettrodi dipenda direttamente dalla quantità di elettricità che è circolata: il numero di moli di sostanza ossidata o ridotta è correlato, attraverso la stechiometria della reazione elettrodica alla quantità di elettricità che passa nella cella elettrolitica.
Il numero di moli di elettroni implicato in un processo di elettrodo è facilmente valutato attraverso la carica elettrica totale. Poiché la carica di un elettrone è 1,6 10-l9 C, la carica di una mole di elettroni è proprio un Faraday (F). Questa stessa quantità di elettricità potrà liberare mezza mole di un metallo bivalente, un terzo di mole di un metallo trivalente e così via.
Con queste premesse è possibile enunciare le due leggi stechiometriche:
I legge - L'ammontare di elettrolita decomposto durante
il processo di elettrolisi è proporzionale alla quantità totale
di elettricità circolata ![]() , dove i
è l'intensità di corrente e Dt è l'intervallo di tempo per cui tale
corrente è circolata.
, dove i
è l'intensità di corrente e Dt è l'intervallo di tempo per cui tale
corrente è circolata.
II legge - In un processo elettrolitico, descritto da reazioni elettrodiche in cui vengono messi in gioco n elettroni, la massa di ogni specie chimica trasformata o formata a ciascun elettrodo per il passaggio di un Faraday di elettricità è pari al prodotto della massa molare per il coefficiente di reazione diviso per il numero n di elettroni scambiati.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta