| chimica |
|
Problemi risolti
A) In un contenitore del volume di 4 l a 327 °C vengono introdotti 85 g di NH . Si stabilisce il seguente equilibrio
2NH N + 3H
Sapendo che la Kc vale 4,9 , calcolare
a) la concentrazione delle specie chimiche in equilibrio, la pressione esercitata dalla miscela gassosa all'equilibrio e la Kp;
b) come variano le concentrazioni d'equilibrio e la pressione della miscela dopo aver lasciato che il sistema si espanda, a temperatura costante, da un volume di 4l a un volume di 8 l.
a) Calcoliamo la concentrazione iniziale dell'ammoniaca
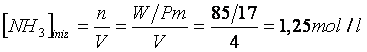
se indichiamo con X la concentrazione dell'azoto all'equilibrio, dall'analisi dei coefficienti stechiometrici deduciamo che ogni 2X moli di NH che reagiscono se ne formano X di N e 3X di H
Costruiamo una tabella in cui compaiano le concentrazioni iniziali e di equilibrio di tutte le specie chimiche in funzione di X.
iniziale d'equilibrio
[NH 1,25 1,25 - 2X
[N 0 X
[H 0 3X
Determiniamo ora il valore di X tramite la relazione di Guldberg-Waage
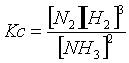
all'interno della quale sostituiamo i valori delle concentrazioni di equilibrio con quelli espressi in funzione di X che troviamo nella tabella precedente, ottenendo
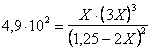
estraendo la radice quadrata di entrambi i membri si ottiene la seguente equazione di 2° grado
![]()
che risolta fornisce il seguente valore X = 0,585 mol/l. Sostitendo tale valore possiamo ora calcolare le concentrazioni di equilibrio
NH eq - 2X = 1,25 - 2 0,585 = 0,08 mol/l
N eq = X = 0,585 mol/l
H eq = 3X = 3 0,585 = 1,755 mol/l
Calcoliamo ora la pressione totale all'equilibrio
Per la legge di Dalton sulle miscele gassose, la pressione totale è uguale alla somma delle pressioni parziali
![]()
La pressione parziale di ciascun gas è calcolabile tramite l'equazione di stato dei gas perfetti. Ad esempio per l'ammoniaca essa è pari a
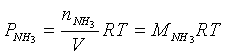
sostituendo i valori così trovati per tutti e tre i gas nella relazione di Dalton si ottiene
![]()
Calcoliamo ora la Kp
![]()
b) Calcoliamo le nuove concentrazioni di equilibrio e la pressione dopo l'espansione.
Aumentare il volume del recipiente significa in pratica diminuire la pressione. Per il principio di Le Chatelier ci dobbiamo attendere che il sistema modifichi il suo equilibrio spostandosi verso destra dove sono presenti un numero maggiore di moli.
Ricalcoliamo la concentrazione iniziale dell'ammoniaca che passa da 1,25 mol/l a
![]()
Ricalcoliamo ora le concentrazioni di equilibrio a partire da una concentrazione iniziale di NH pari a 0,625 mol/l
iniziale d'equilibrio
[NH 0.625 0,625 - 2X
[N 0 X
[H 0 3X
Determiniamo il valore di X tramite la relazione di Guldberg-Waage
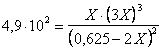
Dopo aver estratto la radice quadrata e risolto l'equazione di 2° grado si ottiene il seguente valore
X = 0,302 mol/l
le nuove concentrazioni di equilibrio saranno perciò
[NH3]eq - 2X = 1,25 - 2 0,302 = 0,021 mol/l
[N2]eq = X = 0,302 mol/l
[H2]eq = 3X = 3 0,302 = 0,906 mol/l
La percentuale di moli che hanno reagito all'equilibrio è ora pari a
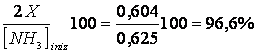
Mentre quando il volume era di 4 l tale percentuale risultava pari a
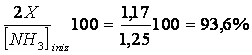
Dunque la diminuzione della pressione ha spostato l'equilibrio verso destra (una percentuale maggiore di molecole di NH hanno infatti reagito)
La pressione totale all'equilibrio è ora pari a
![]()
B) In un reattore di 1 litro a 2000 °K vengono introdotti 57,2 g di CO e 2,6 g di H , Si stabilisce il seguente equilibrio
CO + H CO +H O
Sapendo che a 2000 °K la Kc = 4,40, calcolare
a) le concentrazioni di equilibrio
b) come variano le concentrazioni di equilibrio se vengono introdotti 7 g di CO
c) come variano le concentrazioni di equilibrio se la concentrazione iniziale di H è 2 M
d) quale deve essere la concentrazione iniziale di H2 affinchè il vapor d'acqua che si forma sviluppi all'equilibrio una pressione parziale di 20 atm.
Calcoliamo la concentrazione iniziale di CO e di H
![]()
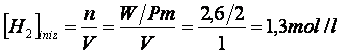
Indichiamo con X la concentrazione di CO all'equilibrio e costruiamo la seguente tabella
iniziale d'equilibrio
[CO 1 1,3 - X
[H 1 1,3 - X
[CO] 0 X
[H O] 0 X
Determiniamo il valore di X tramite la relazione di Guldberg-Waage
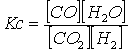
![]()
Estraendo la radice quadrata di entrambi i membri e risolvendo si ottiene
X = 0,88 mol/l
[CO eq = [H eq = 1,3 - X = 1,3 - 0,88 = 0,42 mol/l
[CO]eq = [H O]eq = X = 0,88 mol/l
b) Calcoliamo come variano le concentrazioni di equilibrio introducendo 7 g di CO. Si tratta di aumentare la concentrazione di un prodotto di reazione e per il principio di Le Chatelier ci dovremmo attendere che l'equilibrio regredisca spostandosi a sinistra.
7 g di CO corrispondono a W/Pm =7/28 = 0,25 moli
La nuova tabella delle concentrazioni sarà
iniziale d'equilibrio
[CO 1 1,3 - X
[H 1 1,3 - X
[CO] 0 X + 0,25
[H O] 0 X
Scriviamo la relazione di equilibrio
![]()
si ottiene un'equazione di 2° grado che risolta da il seguente risultato X = 0,843 mol/l
Le nuove concentrazioni di equilibrio diventano
[CO eq = 1,3 - X = 1,3 - 0,843 = 0,457 mol/l
[H eq = 1,3 - X = 1,3 - 0,843 = 0,457 mol/l
[CO eq = X + 0,25 = 0,843 + 0,25 = 1,093 mol/l
[H O]eq = X = 0,843 mol/l
Come si può notare la concentrazione dei reagenti è aumentata (0,457 > 0,42) rispetto al caso precedente: l'equilibrio si è spostato a sinistra.
c) calcoliamo come variano le concentrazioni di equilibrio se la concentrazione iniziale di H e 2 M anzichè 1,2 M. Ci si deve attendere che, aumentando la concentrazione di un reagente l'equilibrio si sposti verso destra.
La nuova tabella delle concentrazioni sarà
iniziale d'equilibrio
[CO 1 1,3 - X
[H 2 2 - X
[CO] 0 X
[H O] 0 X
Scriviamo la relazione di equilibrio
![]()
risolvendo l'equazione otteniamo X = 1,042 mol/l
Le nuove concentrazioni di equilibrio diventano
[CO eq = 1,3 - X = 1,3 - 1,042 = 0,258 mol/l
[H eq = 2 - X = 2 - 1,042 = 0,958 mol/l
[CO]eq = X = 1,042 = 1,042 mol/l
[H O]eq = X = 1,042 mol/l
Come si può notare la concentrazione dei prodotti di reazione è aumentata (1,42 > 0,88) rispetto al caso a): l'equilibrio si è spostato a destra.
d) Calcoliamo che concentrazioni iniziali devono avere i reagenti affichè il vapor d'acqua all'equilibrio sviluppi una pressione parziale di 20 atm.
Dalla equazione di stato dei gas calcoliamo che concentrazione deve avere il vapor d'acqua per svilippare una pressione di 20 atm a 2000 °K
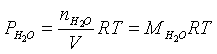
da cui
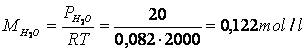
Se la concentrazione di equilibrio del vapor d'acqua è pari a 0,122 mol/l se ne deduce che 0,122 mol/l di H e altrettante di CO hanno reagito e devono essere sottratte alle rispettive concentrazioni iniziali
Posto quindi pari ad Y la concentrazione iniziale di H , le concentrazioni di equilibrio saranno
iniziale d'equilibrio
[CO Y Y - 0,122
[H Y Y - 0,122
[CO] 0 0,122
[H O] 0 0,122
la relazione di equilibrio diventa
![]()
che risolta fornisce il seguente valore Y = 0,18 mol/l
La concentrazione iniziale dell'idrogeno deve quindi essere
Y = [H iniz = 0,18 mol/l
C) In un recipiente a 60 °C vengono introdotti 138 g di N O e 23 g di NO . Si stabilisce il seguente equilibrio
N O 2NO
Sapendo che a 60 °C la Kc = 8,75 10-2 e che all'equilibrio la pressione totale della miscela è pari a 1,47 atm, calcolare la pressione parziale, la concentrazione delle due specie chimiche all'equilibrio e il volume del recipiente.
Calcoliamo la Kp della reazione
![]()
Calcoliamo il numero di moli introdotte
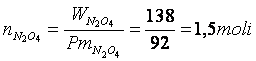
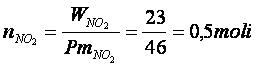
Posto pari ad X il numero di moli di ipoazotide N O che reagiscono, 2X saranno le moli di biossido di azoto NO che si formano.
All'equilibrio saranno quindi presenti
(1,5 - X) moli di N O
(0,5 + 2X) moli di NO
per un totale di (1,5 - X) + (0,5 + 2X) = (2 + X) moli
Le frazioni molari di ciascun gas e le rispettive pressioni parziali in funzione di X saranno perciò
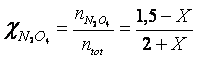
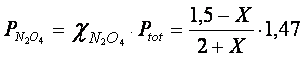
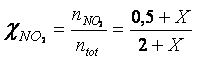
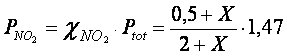
Utilizziamo le pressioni parziali nella relazione di equilibrio espressa come Kp
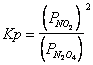
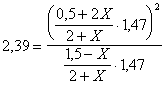
Otteniamo un'equazione di 2° grado che, risolta, fornisce il seguente risultato: X = 0,69 moli
Sostituendo opportunamente il valore trovato possiamo determinare le frazioni molari e le pressioni parziali dei due gas all'equilibrio, che assumono i seguenti valori
![]()
![]()
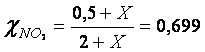
![]()
Poichè le pressioni parziali all'equilibrio sono direttamente proporzionali alle rispettive concentrazioni di equilibrio, possiamo facilmente calcolare queste ultime con l'equazione di stato dei gas perfetti
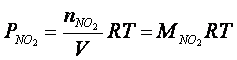
da cui
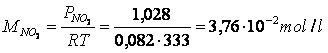
e
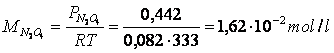
Calcoliamo ora il volume del recipiente
Poichè all'equilibrio si formano complessivamente 2 +X = 2 + 0,69 = 2,69 moli e la pressione totale è di 1,47 atmosfere, il volume sarà uguale a
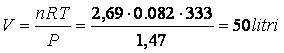
Si noti che avendo calcolato il volume le concentrazioni di equilibrio potevano essere determinate anche:
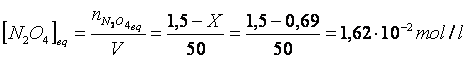
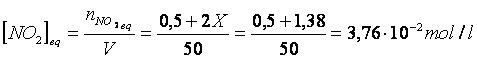
Problemi da risolvere
1. CO + H CO +H O
A 1120°C le concentrazioni di equilibrio delle diverse specie chimiche sono le seguenti:
[CO ] = [H ] = [CO] = 0,01M [H O] = 0,02M
Calcolare la Kc
2. PCl PCl +Cl
Sapendo che la costante di equilibrio a 200°C e' Kc = 0,457 mol/l, calcolare quanti grammi di Pentacloruro rimangono indecomposti all'equilibrio(g) in un recipiente di 30 l. La Concentrazione iniziale del Pentacloruro e' 0,3 M
Calcolare inoltre la pressione sviluppata dalla miscela dei 3 gas una volta raggiunto l'equilibrio.
3. L'acido solfidrico a 1065°C si decompone secondo la reazione
H S H + S
Sapendo che la Kc = 1,1 mol/l, calcolare quanti grammi di zolfo si formano all'equilibrio in un recipiente di 5 l in cui la concentrazione iniziale di acido solfidrico era 0,7M
4. A 60°C la reazione N O 2NO presenta Kc = 8,75 mol/l. Se poniamo 50 g di N O gassoso in un recipiente di 1 l, quale sara' la pressione sviluppata dai due gas all'equilibrio?
5. In un recipiente del volume di 1 l avviene la seguente reazione:
SbCl (g) SbCl (g) + Cl (g)
sapendo che a 212°C la Kp vale 0,338 atm, calcolare quante moli di SbCl non si decompongono e sono presenti all'equilibrio se nel recipiente vengono inizialmente introdotte 2,75 moli di SbCl
6. In un reattore portato alla temperatura di 1023°K avviene la reazione
C(s) + CO (g) 2CO(g)
per la quale la costante di equilibrio Kp vale 3,1 atm. Calcolare la composizione percentuale della fase gassosa all'equilibrio se la pressione totale è di 5 atm e la Kc alla temperatura data.
7. In un recipiente di 2 l alla temperatura di 703°K avviene la seguente reazione
CO g) + H (g) CO(g) + H O(g)
Calcolare la quantità in grammi di CO e H O presenti all'equilibrio se inizialmente sono presenti 88 g di CO e 4 g di H
8. In un recipiente ermeticamente chiuso del volume di 10 l sono stati introdotti SO e O gassosi. Calcolare la costante Kc sapendo che all'equilibrio sono presenti 7 moli di SO , 3 moli di SO e 912,5 moli di 0
9. Nella reazione 2H O(g) O (g) + 2H (g), a 1227°C, la costante di equilibrio vale Kp = 4 -l2 atm. Calcolare la Kc.
In un recipiente di 5 l a 400°C viene introdotta 1 mole di NH (g). Si produce la seguente reazione
NH N + H
Dopo aver bilanciato, calcolare Kc e Kp sapendo che all'equilibrio N M.
In un recipiente di 5 l viene introdotta 1 mole di N e 1 mole di O . Se si riscalda la miscela fino a 2000°C, quante moli di NO si formeranno sapendo che a quella temperatura Kc = 0,1.
12. Data la reazione N (g) + 3H (g) 2NH (g), calcolare la Kc a 300°C, sapendo che in un recipiente di 5 l la miscela dei tre gas all'equilibrio è formata da 1 mole di NH , 0,1 moli di N e 3 moli di H
In un recipiente di 10 l vengono introdotte 10 moli di N e 10 moli di NO. Calcolare la concentrazione delle specie chimiche all'equilibrio per la reazione N + O 2NO (Kc = 3,46
14. Il biossido di azoto è un gas in equilibrio con la sua forma dimera, l'ipoazotide, secondo il seguente equilibrio 2NO N O
Calcolare la Kc di tale reazione, sapendo che dopo aver inizialmente introdotto 92 g di biossido in un recipiente di 1 litro si trovano all'equilibrio 0,5 moli di N O
15. Data la seguente reazione: 2NOBr(g) 2NO(g) + Br (g)
Calcolare la Kp sapendo che a 25°C e ad una pressione di 0,25 atm (pressione totale della miscela di gas all'equilibrio) il bromuro di nitrosile (NOBr) è dissociato al 34%.
16. Data la seguente reazione CO(g) + H O(g) CO (g) + H (g) la cui costante di equilibrio a 986°C vale 0,63; calcolare la concentrazione di equilibrio dell'idrogeno e la pressione parziale di ciascun gas, se una miscela inizialmente composta di 1 mole di vapor d'acqua e da 3 moli di CO, raggiunge il suo equilibrio ad una pressione totale di 2 atmosfere. Calcolare inoltre il volume del recipiente e la molarità del vapor d'acqua all'equilibrio.
17. Le costanti di equilibrio Kp delle seguenti rezioni vengono date a 0°C
SrCl 6H O(s) SrCl 2H O(s) + 4H O(g) Kp = 6,89 -l2 atm
Na HPO 12H O(s) Na HPO 7H O(s) + 5H O(g) Kp = 5,25 -l3 atm
Na SO 10H O(s) Na SO (s) + 10H O(g) Kp = 4,08 atm
Sapendo che la tensione di vapore dell'acqua a 0°C è di 4,58 mm, calcolare:
a) la tensione di vapore dell'acqua in equilibrio a 0°C con i tre sali;
b) quale dei tre sali reagenti è il disidratante più efficace;
c) per quali valori di umidità relativa dell'aria Na SO 10H 0 diventa efflorescente a 0°C.
18. A 27 °C e 1 atm il 20% delle molecole di ipoazotide si trasformano in biossido di azoto secondo la reazione N O 2NO Determinare la Kp e la Kc.
RISOLUZIONI
1. Kc = 2
2. 584 gr 19,65 atm
3. 1,36 g
4. 17,6 atm
5. 1,59 moli
6. 46,4% CO e 53,6% CO Kc = 3,69 mol/l
7. 18,66 g 12 g
8. 5,97 (mol/l)-l
9. 3,25 -l4 mol/l
10. Kc = 1 (mol/l) Kp = 5,8 atm
11. moli
12. 9,26 (mol/l)
13. N = 1,475 M O = 0,475 M NO = 5 M
14. 0,5 (mol/l)-l
15. 9,64 atm
16. 0,68 moli di H PCO = 1,16 atm PH O = 0,16 atm PCO = PH = 0,34 atm V = 206,5 l
H Oeq M
17. a) 1 mm; 2,66 mm; 2,77 mm
b) SrCl 2H O poichè possiede la pressione di vapor d'acqua d'equilibrio (1,23 mm) più bassa
c) inferiori a 60,5% (= 2,77/4,58)
18. Kp = 0,17 atm Kc = 6,91
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta