| chimica |
|
Problemi risolti
A) Calcolare la concentrazione delle specie chimiche all'equilibrio, in una soluzione 3 M di H S, sapendo che la costante di prima dissociazione vale K e la costante di seconda dissociazione vale K -l4
Negli acidi poliprotici devono essere considerati i diversi equilibri di dissociazione. Nel caso particolare gli equilibri sono i seguenti
H S H + HS
HS H + S
In teoria i due equilibri andrebbero considerati contemporaneamente in quanto gli ioni H+ prodotti da ciascuna dissociazione rappresentano un prodotto di reazione per l'altra e ciascun equilibrio tende perciò a regredire spostandosi verso sinistra.
Chiamando X la concentrazione di ioni H+ prodotta dal primo equilibrio e Y la concentrazione di ioni H+ prodotta dal secondo equilibrio, sarebbe necessario risolvere il seguente sistema di equazioni, che garantisce che entrambe le condizioni di equilibrio siano contemporaneamente soddisfatte.

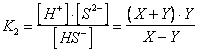
La risoluzione risulta però lunga e laboriosa, generando tra l'altro un'equazione di 4° grado.
Nella maggior parte dei casi è possibile ricorrere ad un metodo di soluzione semplificato. In particolare, quando K risulta maggiore di K di almeno 3-4 ordini di grandezza è possibile considerare il primo equilibrio di dissociazione prevalente e procedere alla soluzione separata dei due equilibri.
Prendiamo dunque in considerazione il primo equilibrio come se non fosse presente il secondo

La soluzione dell'equazione di 2° grado ci fornisce il seguente valore X = [H I = [HS
Dove [H I rappresenta la concentrazione di ioni H+ prodotti dalla prima dissociazione.
Utilizziamo ora la concentrazione di HS trovata, come concentrazione iniziale per la seconda dissociazione e teniamo conto in questo caso che gli ioni H provenienti dalla prima dissociazione spostano l'equilibrio verso sinistra

Essendo la Ka estremamente piccola Y avrà un valore che potrà essere tranquillamente trascurato sia nella somma a numeratore che nella differenza a denominatore. Otteniamo in tal modo il seguente risultato Y = [H II = [S -l4
Come si può notare la concentrazione di ioni H provenienti dalla seconda dissociazione è talmente bassa che, anche se sommata alla concentrazione degli ioni H proveniente dalla prima dissociazione non ne modifica il valore
[H tot = [H I + [H II = X + Y = 5,47*10 + 1 -l4 5,47
Possiamo inoltre verificare che gli ioni H provenienti dalla seconda dissociazione sono in concentrazione talmente esigua da giustificare la trattazione separata del primo equilibrio. La loro presenza in soluzione sposta infatti l'equilibrio di prima dissociazione verso sinistra di una quantità assolutamente trascurabile.
B) Calcolare il pH e le concentrazioni delle specie presenti all'equilibrio in una soluzione 1,5 M in acido acetico (Ka = 1,76 ) e 1,8 M in acido dicloroacetico (Ka = 3,32
I problemi relativi a miscele di due acidi deboli sono analoghi a quelli relativi a soluzioni di acidi poliprotici (vedi problema precedente). In linea teorica infatti i due equilibri di dissociazione si influenzano reciprocamente, per cui gli ioni H prodotti da ciascun acido spostano verso sinistra l'equilibrio di dissociazione dell'altro.
In pratica ciò comporta degli effetti evidenti solo se i due acidi hanno più o meno la stessa forza. Se invece le due costanti di dissociazione differiscono per almeno 3-4 ordini di grandezza, è possibile considerare l'equilibrio dell'acido più forte come prevalente (in modo analogo si è considerato prevalente il primo equilibrio di dissociazione di un acido debole biprotico) e non influenzato dalla presenza dell'acido più debole.
In questo caso i due equilibri presenti in soluzione sono i seguenti
CHCl COOH CHCl COO + H
CH COOH CH COO + H
Se poniamo
X = concentrazione di acido dicloroacetico che si dissocia = [H prodotta dall'acido dicloroacetico
MDCAc = concentrazione iniziale dell'acido dicloroacetico
KDCAc = costante di dissociazione dell'acido dicloroacetico
Y = concentrazione di acido acetico che si dissocia = [H prodotta dall'acido acetico
MAc = concentrazione iniziale dell'acido acetico
KAc = costante di dissociazione dell'acido acetico
la soluzione esatta del problema richiederebbe la soluzione del seguente sistema di equazioni in cui devono essere simultaneamente soddisfatte le due condizioni di equilibrio
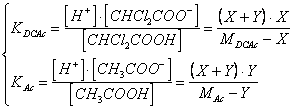
e porterebbe a dover risolvere un'equazione di grado superiore al secondo.
Possiamo invece risolvere il problema in modo semplificato poichè l'acido dicloroacetico (pur essendo un acido debole) è sensibilmente più forte dell'acido acetico. Possiamo quindi assumere il suo equilibrio come preponderante.
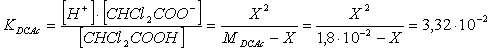
la soluzione dell'equazione di 2° grado ci fornisce il seguente risultato
X = [H DCAc = [CHCl COO = 1,3 mol/l
[CHCl COOH mol/l - X = 5 mol/l
Utilizziamo ora la H trovata introducendola nell'equilibrio di dissociazione dell'acido acetico
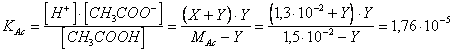
Tenendo presente che la KAc è sufficientemente piccola, il valore di Y sarà così basso da poter essere trascurato nella somma a numeratore e nella differenza a denominatore, ottenendo
Y = [H Ac = [CH COO = 2,03 mol/l
[CH COOH = 1,5 - Y 1,5 mol/l
La concentrazione totale degli ioni H sarà data da
[H tot = [H DCAc + [H Ac = 2,03*10 1,3 mol/l
In altre parole la H dipende esclusivamente dall'equilibrio di dissociazione dell'acido più forte.
Infine il pH sarà uguale a
![]()
C) Calcolare la concentrazione delle specie chimiche all'equilibrio in una soluzione 2 M in acido formico HCOOH (Ka = 1,8 ) e 1,3 M in acido cianico HCNO (Ka = 2,2
Gli equilibri presenti in soluzione sono i seguenti
HCOOH HCOO + H
HCNO HCN + H
Se poniamo
X = concentrazione di acido formico che si dissocia = [H prodotta dall'acido formico
M1 = concentrazione iniziale dell'acido formico
K1 = costante di dissociazione dell'acido formico
Y = concentrazione di acido cianico che si dissocia = [H prodotta dall'acido cianico
M2 = concentrazione iniziale dell'acido cianico
K2 = costante di dissociazione dell'acido cianico
la soluzione esatta del problema richiederebbe la soluzione del seguente sistema di equazioni in cui devono essere simultaneamente soddisfatte le due condizioni di equilibrio
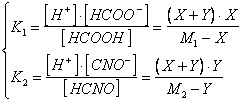
e porterebbe a dover risolvere un'equazione di grado superiore al secondo.
In questo caso le due costanti di dissociazione hanno valori dello stesso ordine di grandezza e non è possibile considerare uno dei due equilibri prevalente sull'altro. E' comunque possibile ricorrere ad una soluzione semplificata poichè entrambi gli acidi sono sufficientemente concentrati e presentano una Ka sufficientemente piccola da permetterci di ritenere che il loro grado di dissociazione sia molto basso. In altre parole sia X che Y devono essere sufficiente piccole rispetto a M1 e M2 da poter essere trascurate nelle differenze a denominatore.
Il sistema diventa così
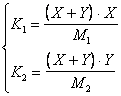
e può essere facilmente risolto ottenendo i seguenti risultati
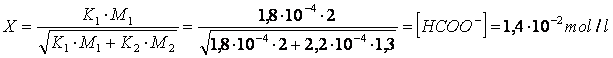
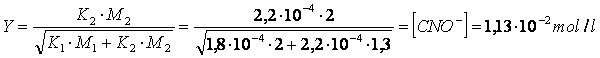

Problemi da risolvere
1. Calcolare il pH e la concentrazione degli acetato CH COO e benzoato C H COO di una soluzione 2 M in acido acetico (Ka = 1,8 ) e 1 M in acido benzoico (Ka = 6,5
2. Calcolare la concentrazione di equilibrio degli ioni H e dell'anione acetato CH COOH- in una soluzione 0,1 M in CH COOH e 0,05 M in HCl, sapendo che la Ka dell'acido acetico è pari a 1,8
3. Calcolare la concentrazione di equilibrio degli ioni H , dell'anione acetato e dell'anione cianuro in una soluzione 0,1 M in CH COOH (Ka = 1,8 ) e 0,2 M in HCN (Ka = 4,8 -l0
4. Calcolare la concentrazione di equilibrio degli ioni H , H PO4 , HPO , PO in una soluzione di acido ortofosforico 10 M sapendo che k , k e k -l3
Calcolare il pH di una soluzione ottenuta mescolando 25 ml di una soluzione 1,7 M di acido acetico CH COOH (Ka = 1,8 ) con 75 ml di una soluzione 2,8 M di acido cianidrico HCN (Ka = 4 -l0
6. Sapendo che la Kb dell'ammoniaca è pari a 1,8 , calcolare il pH ed il grado di dissociazione di una soluzione 8 M e di una soluzione 5 M.
7. Calcolare la concentrazione di acido fluoracetico CHFCOOH (Ka = 2,6 ) necessaria ad ottenere una concentrazione di ioni H M.
8. Calcolare la concentrazione di ioni ammonio NH di una soluzione 2 M in NH (Kb = 1,8 ) e 10 M in KOH.
9. Determinare che molarità deve possedere una soluzione di ammoniaca (Kb = 1,8 ) affinchè la concentrazione degli ioni OH sia pari a 1,5 mol/l.
10. Calcolare la concentrazione dell'anione acetati HCOO in una soluzione 1,5 M in acido acetico HCOOH (Ka = 1,8 ) e 2 M in HCl.
11. Determinare il pH e le concentrazioni di equilibrio degli anioni lattato CH CHOHCOO e fenato C H O di una soluzione 3 M in acido lattico (o acido 2 idrossipropanoico) CH CHOHCOOH (Ka = 8,4 ) e 0,1 M in fenolo C H OH (Ka = 1 -l0
12. Calcolare la concentrazione degli ioni H e degli ioni S di una soluzione 5 M di H S (K K -l3
13. Calcolare la concentrazione degli ioni S di una soluzione 5 M in acido solfidrico (K ; K -l3) e 1 M in HCl.
14. Calcolare il grado di dissociazione di una soluzione 6,5 M di acido cloroacetico (Ka = 1,4
15. Calcolare la concentrazione degli ioni H e CCl COO di una soluzione 1 M in acido dicloroacetico (Ka = 5,5 ) e 1 M in HCl.
RISOLUZIONI
pH = 3 CH COO C H COO
CH COO H = 0,05 + 3,6 0,05
CN H = CH COO
H+ = H PO HPO PO -l8
pH = 5,5
= 1,5% pH = 11,08 = 17,26% pH = 9,94
3,54 M
3,6 M
0,12 M
11. pH = 2,7 CH CHOHCOO C H O
12. H S -l3
-l8
14. = 36,9%
15. H CCl COO
Problemi risolti
A) Calcolare le concentrazioni di equilibrio delle specie chimiche ed il pH di una soluzione 1,85 M di acetato di sodio CH COONa, sapendo che la Ka dell'acido acetico è pari a 1,76
Come tutti i sali anche l'acetato di sodio in soluzione è completamente dissociato secondo la reazione
CH COONa CH COO + Na
Poichè tale equilibrio è completamente spostato verso destra, inizialmente in soluzione vi sono 1,85 mol/l di ione acetato e 1,85 mol/l di ione sodio, le quali partecipano ai seguenti equilibri
NaOH Na +
CH COOH CH COO + H
Mentre il primo equilibrio è completamente spostato verso destra (l'idrossido di sodio è una base forte), il secondo è spostato verso sinistra (l'acido acetico è un acido debole). In questo modo l'anione acetato tende ad unirsi con gli ioni H che trova in soluzione per dare acido acetico indissociato.
Gli ioni H vengono sottratti all'equilibrio di dissociazione dell'acqua, il quale, in risposta tende a spostarsi verso sinistra dissociando altri ioni H e ioni OH . Ma mentre gli ioni H vengono intercettati dall'anione acetato gli ioni OH rimangono in soluzione alzando il pH.
I due equilibri, che si influenzano reciprocamente, sono dunque
CH COOH CH COO + H
H O
Per risolvere il problema in modo esatto sarebbe necessario considerare simultaneamente i 2 equilibri in modo che siano contemporaneamente soddisfatte le equazioni derivate dalle relative condizioni di equilibrio
Se indichiamo con
Y = la quantità di acqua che si dissocia liberando Y mol/l di ioni OH- e Y mol/l di ioni H+
X = la quantità di anione acetato che si riassocia rubando X mol/l di ioni H+ per formare X mol/l di acido indissociato
M = concentrazione iniziale del sale = concentrazione iniziale dell'anione acetato
![]()
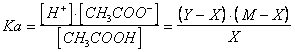
Le due equazioni formano un sistema che richiede la soluzione di un'equazione di 3° grado.
Quando, come in questo caso, la concentrazione iniziale del sale è sufficientemente elevata, è possibile evitare di ricorrere alla soluzione esatta del problema, introducendo alcune semplificazioni nella trattazione.
Si ipotizza che per ogni molecola di CH COOH che si forma dalla unione di un CH COO con un H , una molecola d'acqua si dissoci per ridare lo ione H e uno ione OH . In questo modo si devono formare all'equilibrio tante molecole di CH COOH quanti ioni OH
In effetti ciò rappresenta solo una approssimazione in quanto la liberazione di ioni OH da parte dell'anione acetato che si riassocia, tende a far retrocedere l'equilibrio di dissociazione dell'acqua (gli ioni OH rappresentano un prodotto di reazione per l'equilibrio di dissociazione dell'acqua), in modo tale che una minima percentuale degli ioni OH liberati si riassocia per formare acqua.
L'entità di tale processo è comunque minima e non influisce sulla concentrazione degli ioni OH la quale è determinata essenzialmente dall'equilibrio dell'acido che si riassocia. Diviene necessario tener conto anche dell'equilibrio dell'acqua solo quando il sale è molto diluito.
La reazione semplificata che si ipotizza avvenga è detta reazione di idrolisi ed è la seguente
CH COO + H O CH COOH + OH
E' facile verificare che la sua costante di equilibrio, la costante di idrolisi, vale
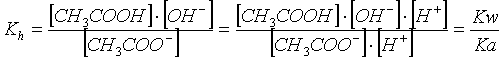
Se dunque indichiamo con X la quantità di CH COO che si riassocia per dare X mol/l di CH COOH, mentre vengono contemporaneamente liberate X mol/l di ioni OH , otterremo la seguente equazione

risolvendo l'equazione otteniamo
X = [
[H = Kw/
[CH COO = M - X = 1,85 - 3,24 1,85
B) Calcolare il pH le concentrazioni di equilibrio delle specie chimiche in una soluzione 1 M di acetato di sodio, sapendo che la costante di dissociazione dell'acido acetico è Ka = 1,76
Come nel problema precedente lo ione acetato si riassocia con gli ioni H provenienti dalla dissociazione dell'acqua per dare l'acido acetico indissociato. Gli ioni OH liberati rendono basica la soluzione.
Proviamo ad utilizzare il metodo semplificato
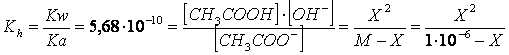
Risolvendo l'equazione otteniamo
X = OH = CH COOH = 2,35*10 mol/l
Il risultato è chiaramente inaccettabile in quanto ci porta a concludere che, nonostante la liberazione di una seppur minima quantità di ioni OH , la soluzione è diventata acida.
Il metodo semplificato non può essere utilizzato in questo caso in quanto la concentrazione iniziale dell'anione acetato è eccessivamente bassa e la quantità di ioni OH prodotta dalla sua riassociazione è abile con la quantità di ioni OH provenienti dall'equilibrio di dissociazione dell'acqua (10
Sarebbe comunque errato semplicemente sommare gli ioni OH provenienti dall'idrolisi salina (2,35 ) con gli ioni OH- provenienti dall'acqua (10 ). In questo caso infatti la presenza di un sia pur piccolo eccesso di ioni OH- provenienti dall'idrolisi salina fa retrocedere in modo sensibile, rispetto alle concentrazioni in gioco, l'equilibrio dell'acqua. Una parte non trascurabile degli ioni OH- proodotti dall'idrolisi salina si riassocia con gli ioni H+ per dare acqua indissociata.
Ci dobbiamo perciò attendere che la concentrazione di equilibrio degli ioni OH- sia leggermente inferiore della semplice somma ( 10 + 2,35
Risolvendo il problema in modo esatto, attraverso la procedura completa scriviamo
![]()
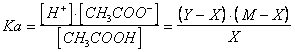
dividendo membro a membro si ottiene

In cui notiamo che l'ipotesi semplificatrice è stata abbondonata, infatti [OH ≠ [CH COOH
Esplicitando la X
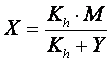
e sostituendone il valore nel prodotto ionico dell'acqua si ottiene la seguente equazione di 3° grado
![]()
Che risolta per approssimazioni successive fornisce il seguente risultato
Y = [
X = [CH COOH] = 5,51 mol/l
[H = Kw/
[CH COO = M - X = 1 1 mol/l
Si noti che la concentrazione degli ioni OH , pur essendo maggiore di 10 , è minore della semplice somma degli ioni OH provenienti dai due equilibri trattati separatamente (10 ). la trattazione contemporanea dei due equilibri ha dimostrato che essi, interagendo, retrocedono entrambi leggermente spostandosi verso sinistra.
Si noti infine che nonostante l'acido acetico sia molto debole una minima percentuale di ioni acetato si riassocia, X mol/l su M mol/l iniziali, pari a 5,51 = 5,5 . Poco più di 5 molecole su 1000. Il dato conferma la regola che anche gli acidi deboli, quando sono molto diluiti sono quasi completamente dissociati.
C) Calcolare il pH di una soluzione 0,1 M di cianato d'ammonio NH CNO, sapendo che la Kb dell'ammoniaca NH è Kb = 1,8 , mentre la Ka dell'acido cianico HCNO è Ka = 2,2
Il cianato d'ammonio è completamente dissociato secondo l'equilibrio
NH CNO NH + CNO
Sia lo ione ammonio che lo ione cianato interagiscono con l'equilibrio di dissociazione dell'acqua. il primo per ridare la base debole NH , il secondo per ridare l'acido debole HCNO
NH + H O NH + OH
HCNO CNO + H
lo ione ammonio sottrae ioni OH , mentre lo ione cianato sottrae ioni H . Poichè Ka > Kb l'equilibrio dell'acido cianico è più spostato verso destra di quello dell'ammoniaca. Ci dobbiamo perciò attendere che la soluzione finale sia leggermente acida.
La soluzione esatta del problema richiede che i due equilibri siano considerati simultaneamente e assieme all'equilibrio di dissociazione dell'acqua.
Se indichiamo con
Z = quantità di acqua che si dissocia all'equilibrio in Z mol/l di ioni H e Z mol/l di ioni OH
X = la quantità di CNO che si riassocia, sottraendo X mol/l di ioni H all'acqua, per dare X mol/l di acido cianico indissociato
Y = quantità di NH che reagisce, sottraendo Y mol/l di ioni OH all'acqua, per dare Y mol/l di ammoniaca
M = concentrazione iniziale del sale e quindi, essendo il sale completamente dissociato, degli ioni ammonio e degli ioni cianato.
otterremo le seguenti 3 equazioni, desunte dalle condizioni di equilibrio delle tre reazioni
![]()
![]()
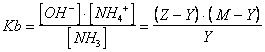
la cui risoluzione risulta lunga e laboriosa richiedendo infine la soluzione di un'equazione di 4° grado
Ci si avvale pertanto di un metodo approssimato che assume le seguenti ipotesi semplificatrici:
Le concentrazioni di equilibrio degli ioni H+ e OH- sono talmente piccole (sia l'acido che la base sono deboli) da non poter influenzare la condizione di elettroneutralità, la quale passa perciò dalla forma
![]()
alla forma approssimata
![]()
Ciò significa in pratica che se all'equilibrio la concentrazione dello ione ammonio può essere grossolanamente considerata pari a quella dello ione cianato, una pari quantità dei due ioni si sarà riassociata per dare la base e l'acido di partenza e sarà perciò anche
![]()
In altre parole si considerano l'equilibrio dell'acido e della base spostati della stessa quantità, per ogni ione ammonio che si trasforma in ammoniaca, uno ione cianato si trasforma in acido cianico secondo la reazione approssimata
NH + CNO NH + HCNO
La cui costante di equilibrio (costante di idrolisi) vale
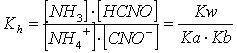
se quindi indichiamo con
X = [NH = [HCNO
allora sarà
[NH = [CNO = M -X
sostitendo opportunamente nella relazione di equilibrio otterremo
![]()
che risolta fornisce i seguenti risultati
X = [NH = [HCNO mol/l
[NH = [CNO = M - X = 0,1 - 1,58 mol/l
sostitendo tali valori nelle relazioni di equilibrio dell'acido e dalla base si otterranno infine le concentrazioni degli ioni H e OH
 da cui [H
da cui [H
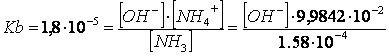 da cui [OH
da cui [OH
D) Calcolare il pH di una soluzione 5 M di fosfato biacido di sodio NaH PO sapendo che la costante di prima dissociazione dell'acido fosforico vale K1 = 7,1 e la costante di seconda dissociazione vale K2 = 6,2
Il sale è completamente dissociato secondo l'equilibrio
NaH PO Na + H PO
l'anione fosfato biacido in acqua presenta un comportamento anfotero, partecipando ai seguenti due equilibri opposti
H PO + H O NaH PO + OH Kh = Kw/K1 = 1,4 -l2
H PO HPO + H K2 = 6,2
Osservando il valore delle rispettive costanti deduciamo che il primo equilibrio (equilibrio di idrolisi basica) è più spostato verso sinistra rispetto al secondo (equilibrio di seconda dissociazione dell'acido). La soluzione all'equilibrio sarà pertanto acida.
La soluzione esatta del problema richiederebbe che venissero presi contemporaneamente in considerazione i seguenti 3 equilibri
H O H + OH
H PO H PO + H
H PO HPO + H
se indichiamo con
Z = la quantità di acqua che si dissocia in Y mol/l di ioni H e Y mol/l di ioni OH
X = la quantità di anione fosfato biacido H PO che si riassocia, sottraendo X mol/l di ioni H , per dare X mol/l di acido indissociato H PO
Y = la quantità di anione fosfato biacido H PO che si dissocia, producendo Y mol/l di ioni H e Y mol/l di anione fosfato monoacido HPO
M = la concentrazione iniziale del sale che, essendo completamente dissociato, è pari alla concentrazione iniziale dell'anione fosfato biacido H PO
allora le condizioni di equilibrio diventano
![]()
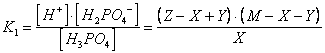
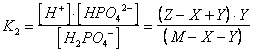
Anche in questo caso è comunque possibile ricorrere ad un metodo approssimato che si avvale delle seguenti ipotesi semplificatrici:
Si suppone che per ogni anione fosfato biacido che si trasforma in acido fosforico indissociato, un anione fosfato biacido si dissoci per dare un anione fosfato monoacido, secondo il seguente equilibrio
H PO HPO + H PO
E' semplice verificare che la costante di tale equilibrio è pari a
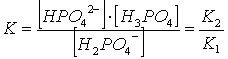
ponendo quindi
X = [H PO = [H PO
la relazione di equilibrio diventa

che, risolta, ci fornisce
X = [H PO = [H PO = ![]() mol/l
mol/l
[HPO = M - 2X = M - 2![]() mol/l
mol/l
per calcolare la concentrazione degli ioni H sostituiamo i valori trovati nell'equilibrio di prima dissociazione dell'acido
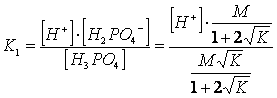
semplifichiamo ed esplicitiamo H , ottenendo
![]()
sostituendo gli stessi valori nell'equilibrio di seconda dissociazione dell'acido, avremmo ottenuto
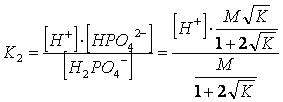
semplificando ed esplicitando H , otteniamo

I 2 valori della H così ottenuti, pur essendo molto vicini non sono identici, trattandosi di una approssimazione. Se ne può calcolare la media geometrica, ottenendo

Il pH varrà quindi 4,68.
Si tenga presente che il metodo semplificato porta a risultati attendibili solo quando
K << M
Kw << K M
Problemi da risolvere
17. Calcolare il pH di una soluzione 0,1 M di NH Cl sapendo che la Kb dell'ammoniaca è pari a 1,8
18. Determinare la Kb di Zn(OH) sapendo che il pH di una soluzione 1 M di ZnCl è 6,33.
19.Calcolare il pH di una soluzione 5 M di K CrO sapendo che la costante di prima dissociazione dell'acido cromico vale K = 0,18 e la seconda è pari a K
20. Calcolare il pH di una soluzione 1 M di Na S sapendo che le costanti di prima e seconda dissociazione dell'acido solfidrico valgono rispettivamente K e K -l3
21. Calcolare il pH di una soluzione 1 M di NaHCO sapendo che le costanti di prima e seconda dissociazione dell'acido carbonico valgono rispettivamente K e K -l1
22. Calcolare la concentrazione degli ioni OH e dello ione ossalato di una soluzione 5 M di ossalato di sodio NaOOC-COONa, sapendo che le costanti di prima e seconda dissociazione dell'acido ossalico HOOC-COOH valgono rispettivamente K e K
23. Calcolare il pH di una soluzione 5 M di NaH PO sapendo che le costanti di prima e seconda e terza dissociazione dell'acido fosforico valgono rispettivamente K K -8 e K -l3
24. Calcolare il pH di una soluzione 5 M di Na HPO sapendo che le costanti di prima e seconda e terza dissociazione dell'acido fosforico valgono rispettivamente K K e K -l3
25. Calcolare il pH di una soluzione 5 M di Na PO sapendo che le costanti di prima e seconda e terza dissociazione dell'acido fosforico valgono rispettivamente K K e K -l3
26. Calcolare il pH e la concentrazione di CO e di H CO di una soluzione 10 M di Na CO sapendo che le costanti di prima e seconda dissociazione dell'acido carbonico valgono rispettivamente K e K -l1
27 . Calcolare il pH di una soluzione 0,1 M di cianato d'ammonio NH CNO sapendo che la Kb dell'ammoniaca NH è pari a 1,8 e la Ka dell'acido cianico HCNO è pari a 2,2
28 . Calcolare la concentrazione delle specie chimiche in una soluzione 1 M di cianuro di ammonio NH CN sapendo che la Kb dell'ammoniaca NH è pari a 1,8 e la Ka dell'acido cianidrico HCN è pari a 4,8 -l0
RISOLUZIONI
17. pH = 5,13
19. pH = 9,1
20. pH = 11
21. pH = 8,29
22.
23. pH = 4,68
24. pH = 9,78
25. pH = 12,38
26. pH = 10,5 CO H CO
27. pH = 6,46
28. H -l0 CN = NH HCN = NH
Problemi risolti
A) Calcolare il pH di una soluzione tampone 0,25 M in acido acetico e 0,7 M in acetato di sodio, sapendo che la Ka dell'acido acetico vale 1,76
Essendo il sale completamente dissociato in soluzione saranno presenti 0,7 mol/l di ioni acetato provenienti dal sale. Poichè il sale è un elettrolita forte il suo equilibrio non viene disturbato dalla presenza di un'altro elettrolita, rimanendo comunque completamente dissociato.
Il problema si riduce perciò al calcolo della variazione dell'equilibrio dell'acido debole in presenza di 10 mol/l del suo anione.
Se indichiamo con X la quantità di acido che si dissocia, con Ma la concentrazione iniziale dell'acido e con Ms la concentrazione iniziale del sale, potremmo scrivere
![]()
risolvendo l'equazione di secondo grado, otteniamo
X = [H+
Come ci si doveva attendere, essendo l'acido molto debole ed essendo l'equilibrio ulteriormente spostato verso sinistra per la presenza dell'anione comune prodotto dal sale, X è trascurabile sia rispetto ad Ms che rispetto ad Ma.
Quando le concentrazioni dell'acido e del sale sono sufficientemente elevate è quindi possibile trascurare la X sia nella somma a numeratore che nella differenza a denominatore. Si ottiene la seguente relazione semplificata
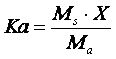
dalla quale otteniamo
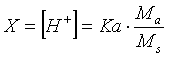
Calcolando il logaritmo negativo di entrambi i membri otteniamo finalmente la relazione per il calcolo del pH in soluzioni tampone

pH = 5,2
B) Calcolare il pH di una soluzione tampone costruita introducendo 3 moli di acido nitrico e 1*10-l moli di carbonato monoacido di sodio NaHCO in un litro di soluzione, sapendo che la costante di prima dissociazione dell'acido carbonico è K
Sia l'acido forte che il sale sono completamente dissociati.
HNO H + NO
NaHCO Na + HCO
I 3 mol/l di ioni H provenienti dall'acido forte interferiscono con l'equilibrio di dissociazione dell'acido debole. L'anione proveniente dal sale tende infatti a riassociarsi quasi completamente con gli ioni H
H CO H + HCO
Verifichiamolo. Detta
Msiniz = la concentrazione iniziale del sale, pari alla concentrazione iniziale dell'anione HCO
Mainiz = la concentrazione iniziale dell'acido nitrico, pari alla concentrazione iniziale degli ioni H
X = la quantità di anione che si riassocia, formando X mol/l di H CO indissociato
la condizione di equilibrio dell'acido debole diventa

risolvendo l'equazione di secondo grado si ottiene
X = H CO mol/l
L'anione si è dunque riassociato in modo praticamente completo
La concentrazione degli ioni H sarà quindi pari a
[H ] = Mainiz - X = 3 = 1,84 mol/l
[HCO = Msiniz - X = 1 -l mol/l
pH = -log 1,84
Tenendo dunque conto che l'acido forte trasforma una pari quantità di anione nel corrispondente acido debole, era possibile utilizzare la relazione approssimata

C) Calcolare il pH di una soluzione tampone ottenuta miscelando 0,3 l di una soluzione 3 M di NaH PO con 0,45 l di una soluzione 1 M di Na HPO , sapendo che la costante di seconda dissociazione dell'acido fosforico vale K
L'effetto tampone si basa sull'equilibrio di dissociazione dell'acido debole fosfato biacido H PO e sulla contemporanea presenza di elevate concentrazioni sia dell'acido debole che del suo anione coniugato (HPO
H PO H + HPO
L'acido debole H PO viene fornito dalla completa dissociazione di NaH PO
L'anione coniugato HPO viene fornito dalla completa dissociazione di Na HPO
Calcoliamo la concentrazione iniziale dei due anioni
miscelando le due soluzioni si è ottenuta una soluzione di volume complessivo 0,3 + 0,45 = 0,75 l
In 0,3 litri di soluzione 3 M di NaH PO erano contenute n = M V = 3 moli di H PO
la molarità dell'H PO nella nuova soluzione sarà Ma = n/V = 9 / 0,75 = 1,2 mol/l
Eseguendo lo stesso calcolo anche per l'anione HPO otterremo Ms = 6 mol/l
E' possibile ora utilizzare la relazione semplificata, ottenendo

la risoluzione esatta del problema avrebbe portato allo stesso risultato. Se chiamiamo infatti X la quantità di H PO che si dissocia per dare X mol/l di HPO e X mol/l di ioni H , all'equilibrio avremo
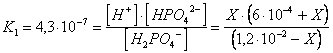
risolvendo l'equazione ottenuta si ottiene il medesimo risultato al quale siamo pervenuti col metodo semplificato.
D) Calcolare il pH di una soluzione tampone preparata introducendo 0,5 moli di HF (Ka = 3,53 ) e 7 10-2 moli di NaOH in un litro di soluzione.
L'effetto tampone si ottiene poichè tutto l'idrossido di sodio salifica una pari quantità di acido fluoridrico. Si formeranno pertanto 7 moli di NaF, completamente dissociato in Na e F , mentre rimarranno in soluzione 0,5 - 7 -l moli di HF indissociato.
Posto dunque X pari alla quantità di acido fluoridrico che si dissocia per dare X mol/l di ioni H e X mol/l di ioni F , sarà
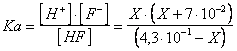
risolvendo l'equazione otterremo
X = [H mol/l pH = 2,68
se avessimo utilizzato il metodo semplificato, trascurando la X nella somma a numeratore e nella differenza a denominatore, avremmo ottenuto
[H mol/l pH = 2,66
Problemi da risolvere
29. Calcolare il pH di una soluzione ottenuta miscelando 100 ml di HCN 1 M con 100 ml di KCN 5 M, sapendo che la Ka dell'acido cianidrico vale 4,9 -l0
30. Calcolare il pH di una soluzione ottenuta miscelando 100 ml di NH OH 4 M con 100 ml di NH Cl 1 M, sapendo che la Kb dell'ammoniaca vale 1,8
31. Calcolare il pH di una soluzione ottenuta miscelando 150 ml di HClO 1 M con 450 ml di KClO 1,25 M sapendo che la Ka dell'acido ipocloroso vale 3
32. Dopo aver miscelato 150 ml di HClO 1 M con 150 ml di KClO 1,25 M, si aggiunge acqua fino ad un litro. Sapendo che la Ka dell'acido ipocloroso vale 3 , calcolare il pH della soluzione e la variazione di pH che si produce aggiungendo 10 ml di HCl 0,1 M
33. Calcolare il pH di una soluzione ottenuta miscelando 250 ml di acido acetico CH COOH 1,5 M (Ka = 1,8 ) con 250 ml di acetato di sodio CH COONa 1,2 M.
34. Calcolare il pH di una soluzione di 350 ml di NH OH (Kb = 1,8 ) 0,1 M alla quale siano stati aggiunti 7,5 g di NH Cl.
35. Una soluzione 1 M di acido cloroacetico CH ClCOOH (Ka = 1,4 ) è anche 2 M in cloroacetato di sodio CH ClCOONa. Calcolare il pH.
36. Calcolare il pH di una soluzione 1 M di HCl. Calcolare inoltre il pH della stessa soluzione quando vengano aggiunte 2 moli di CH COONa per litro di soluzione, sapendo che la Ka dell'acido acetico è pari a 1,8
37. Calcolare il pH di una soluzione 0,2 M in acido dicloroacetico (Ka = 5,5 ) e 0,1 M in dicloroacetato di sodio.
38. Che quantità di dicloroacetato di sodio si deve aggiungere ad un litro di acido dicloroacetico (Ka = 5,5 ) 0,1 M per portare la concentrazione degli ioni H a 3 M.
39. Calcolare che quantità di NaOH si deve aggiungere ad una soluzione 1 M di H BO (Ka = 5,8 -l0) per ottenere una soluzione tamponata a pH 10
RISOLUZIONI
29. pH = 10 30. pH = 9,86 31. pH = 8,10
32. pH = 7,62 DpH = - 0,553 33. pH = 4,65
34. pH = 8,65 35. pH = 2,62 36. pH iniziale = 2 pH finale = 4,74
37. pH = 1,3 38. 0,1 moli 39. 8,5 moli
Problemi risolti
A) Quanti ml di una soluzione 5 M di acido solforico è necessario aggiungere a 250 ml di una soluzione 3,2 M di CaCl affinchè inizi a precipitare CaSO (Kps =3,5
Indichiamo con X i litri di soluzione acida da aggiungere. Il volume della nuova soluzione dopo l'aggiunta diverrà pertanto 0,25 + X. le concentrazioni dello ione calcio e dello ione solfato nella nuova soluzione saranno perciò
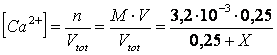
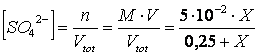
poichè il solfato di calcio precipita quando il prodotto delle concentrazioni dei suoi due ioni eguaglia la Kps, possiamo scrivere

risolvendo l'equazione si ottiene X = 0,06 litri di soluzione acida da aggiungere
B) Calcolare la solubilità in mol/l dell'idrossido ferrico (Kps = 1,1 ) in una soluzione tamponata a pH = 3.
poichè la soluzione è tamponata possiamo ritenere costante la concentrazione degli ioni H , pari a 10 mol/l. Anche la concentrazione degli ioni OH sarà perciò costante e pari a Kw/[H -l1 mol/l.
Infine, poichè deve essere
![]()
La concentrazione dello ione ferrico in soluzione (e quindi dell'idrossido completamente dissociato) sarà
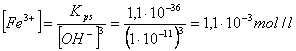
la solubilità dell'idrossido ferrico aumenta notevolmente in ambiente acido.
C) Una soluzione è 0,1 M in MgCl . Calcolare a che pH inizia a precipitare Mg(OH) sapendo che il suo prodotto di solubilità è pari a 1,2 -l1
ponendo [OH ] = X e sapendo che [Mg2
potremo scrivere
![]()
da cui X = [OH mol/l pari ad un pH = 9,04
D) A 50 ml (V ) di una soluzione 1,8 M di Ag SO vengono aggiunti 50 ml (V ) di una soluzione 2,5 M di BaCl . Tenendo conto che le concentrazioni degli ioni in soluzione prodotte dalla completa dissociazione dei due sali sono tali per cui vengono superati i Kps di AgCl (1,56 -l0) e di BaSO -l0), calcolare le concentrazioni residue dei diversi ioni nella soluzione dopo la precipitazione e qunati grammi dei due sali precipitano.
Calcoliamo le nuove concentrazioni di ciascun ione nella soluzione il cui volume finale è pari a 0,05 + 0,05 = 0,1 litro
Ag SO 2Ag + SO
tenendo conto che per ogni mole di solfato d'argento che si dissocia si liberano due ioni Ag e uno ione SO , si avrà
![]()

Eseguendo gli stessi calcoli per il cloruro di bario otterremo
BaCl Ba + 2Cl
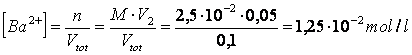
![]()
Chiamiamo ora X le moli di AgCl che si riassociano, precipitando. Potremo allora scrivere
![]()
L'equazione, risolta fornisce il seguente risultato
X = 1,7999977714 mol/l
In pratica il numero di mol/l di AgCl che precipita è pari alla concentrazione iniziale dello ione Ag , il quale, essendo in quantità minore rispetto allo ione Cl , agisce da agente limitante per il processo di precipitazione.
In soluzione rimarranno 2,5 mol/l di ioni Cl e Kps/[Cl mol/l di ioni Ag
Le 1,8 10-2 mol/l di AgCl che precipitano corrispondono a
![]()
ed in 0,1 litri precipiteranno 2,58 0,1 = 0,258 g di AgCl.
Chiamiamo infine Y le moli di BaSO che si riassociano, precipitando. Potremo allora scrivere
![]()
L'equazione, risolta fornisce il seguente risultato
Y = 8,999969143 mol/l
In pratica il numero di mol/l di BaSO che precipita è pari alla concentrazione iniziale dell'anione SO il quale, essendo in quantità minore rispetto allo ione Ba , agisce da agente limitante per il processo di precipitazione.
In soluzione rimarranno 1,25 mol/l di ioni Ba e Kps/[Ba mol/l di ioni SO
Le 9 mol/l di BaSO che precipitano corrispondono a
![]()
ed in 0,1 litri precipiteranno 2,1 0,1 = 0,21 g di BaSO
E) Calcolare la concentrazione degli ioni in una soluzione satura in CaCO (Kps = 1,7 ) e in BaCO (Kps = 7*10
Se poniamo
[Ca ] = X [Ba ] = Y e quindi [CO ] = X + Y
potremo allora scrivere
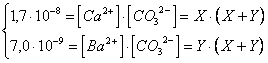
risolvendo il sistema si ottiene
X = [Ca mol/l
Y = [Ba mol/l
X + Y = [CO mol/l
Problemi da risolvere
40. Calcolare la concentrazione di anioni SO che è necessario superare affinchè inizi a precipitare solfato di calcio (Kps = 2,5 ) da una soluzione 3,2*10 M in CaCl
41. Un litro di soluzione è 1*10 M in ioni Mg . Calcolare quanti ml di NaOH 1 M è necessario aggiungere affinchè inizi a precipitare Mg(OH) (Kps = 1,8 -l1
42. Calcolare il prodotto di solubilità del solfato piomboso sapendo che in in 200 ml di soluzione si sciolgono 8 g di PbSO
43. Calcolare la solubilità di Ag CrO espressa in mol/l e in g/l, sapendo che la sua Kps è pari a 1,5 -l2
44. Una soluzione è 1 M in HCl, 4 M in ioni Cu e 1,5 M in ioni Pb . Calcolare che specie chimica precipita e in che quantità sapendo che i prodotti di solubilità di CuCl è di PbCl valgono rispettivamente 3,2 e 1,6
45. Calcolare la massima concentrazione di ioni Zn in una soluzione 1 M di NH senza che si verifichi precipitazione, sapendo che il prodotto di solubilità di Zn(OH) è pari 4,5 -l7 e la Kb dell'ammoniaca è pari a 1,8
46. Calcolare la Kps del fluoruro di calcio sapendo che le sue soluzioni sature contengono 1,7 g/l di sale.
47. Calcolare quanti grammi di AgCl (Kps = 1,6 -l0) precipitano quando si mescolano 25 ml di una soluzione 1 M di AgNO con 500 ml di una soluzione 1 M di HCl. Calcolare inoltre la solubilità in mol/l del cloruro di argento rimasto in soluzione.
48. Calcolare la solubilità in mol/l e in g/l dello iodato piomboso sapendo che la sua Kps = 2,6 -l3
RISOLUZIONI
40. 7,8
41. 170 ml
42. 1,74
43. 7,2 mol/l 2,39 g/l
44. precipitano 8 mol/l di CuCl
45. 2.87
46. 4 -l1
47. precipitano 3,57 g di AgCl rimangono in soluzione 1,77 mol/l
mol/l 2,24 g/l
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta