| chimica |
|
|||||
|

Quest'esperienza di laboratorio si è articolata in sette esperimenti riguardanti le variazioni di temperatura delle masse al variare dei parametri in gioco, che abbiamo identificato come:
massa
temperatura
sostanza
Un'ipotesi comune a tutti gli esperimenti è che il calore ceduto sia completamente assorbito dalla massa con temperatura più bassa, e non si disperda nell'ambiente, almeno entro le incertezze in gioco.
Æ Primo esperimento
Iniziamo definendo la temperatura d'equilibrio:
Dati due corpi A e B a diverse temperature e a contatto fra loro, il calore fluisce spontaneamente dal più caldo al più freddo, fino a quando la temperatura di A è uguale a quella di B, determinando la temperatura d'equilibrio.
Ø Scopo dell'esperimento
Partendo da questa definizione, vogliamo cercare la temperatura d'equilibrio di uguali masse della stessa sostanza a temperature differenti, ipotizzando che il calore ceduto dal corpo più caldo sia uguale al calore assorbito. I parametri in gioco sono dunque:
temperature iniziali diverse
masse uguali
stessa sostanza.
Ø Materiale:
Termometro digitale con risoluzione di 0,1 °C;
Bilancia digitale con risoluzione di 1g e fondoscala di 6000g
Un calorimetro;
Due resistori
Una caraffa;
Acqua
Ø Procedimento operativo
Abbiamo versato l'acqua a temperatura ambiente nella pentola e nella caraffa, poi abbiamo riscaldato quella nella pentola con i resistori collegati al generatore di corrente. Fatto ciò, abbiamo rilevato entrambe le temperature con il termometro ed abbiamo azzerato la bilancia con il calorimetro sopra, in modo da calcolare in seguito la sola massa dell'acqua senza la tara. Questo ha però comportato un'incertezza di misura sulle masse di 2g, poiché l'incertezza cade anche sullo zero.
Usando un calorimetro aperto, potrebbero entrare in gioco delle variazioni di temperatura dovute all'influenza dell'ambiente, così abbiamo aumentato l'incertezza sulle temperature a 0,3 °C, sperando in questo modo di mascherare le variazioni che potrebbero influire sul risultato finale. Successivamente abbiamo versato l'acqua calda nel calorimetro e, dopo averne misurato la massa, abbiamo nuovamente tarato e aggiunto la stessa quantità di acqua fredda. A distanza di qualche minuto abbiamo rilevato la temperatura.
Ø Rilevamento dei dati
Acqua calda:
massa : (157 2)g
temperatura (49.7 0.3)°C
Acqua fredda :
massa ( 157 2 ) g.
temperatura ( 25,6 0,3 ) °C
Temperatura di equilibrio:
0,3 ) °C
Il fatto che la temperatura si sia stabilizzata entro le incertezze, vuol dire che non ci sono interazioni significative con l'ambiente esterno.
Notiamo che la temperatura d'equilibrio si pone all'incirca a metà tra la temperatura dell'acqua calda e quella dell'acqua fredda. Poiché sembra che si ponga come una media tra i due valori, calcoliamo l'effettiva media e controlliamo se sono compatibili.
![]()
Come si vede i due valori sono compatibili.
In verità non sappiamo se le masse sono eguali e se le temperature sono veramente tali, perché dovremmo ripetere le misure e controllare le condizioni sperimentali ( termometri più sensibili ) per evitare scambi di calore, per vedere se effettivamente la temperatura di equilibrio di uguali masse di uguali sostanze a diverse temperature, è data dalla media.
Æ Secondo esperimento
Ø Scopo dell'esperimento
Studiare il comportamento della temperatura di diverse masse della stessa sostanza prima e dopo averle messe a contatto.
I parametri in gioco sono dunque:
temperature iniziali diverse
masse diverse
stessa sostanza.
Ø Materiale:
Termometro analogico con risoluzione di 1 °C e fondoscala di 110°C
Bilancia digitale con risoluzione di 1g e fondoscala di 6000g
Due calorimetri
Acqua
Ø Procedimento operativo
Abbiamo misurato massa e temperatura di due quantità diverse di acqua a diverse temperature, abbiamo tarato la bilancia con sopra il calorimetro (comportando anche in questo caso l'incertezza di 2g), all'interno del quale abbiamo versato le due masse d'acqua. Dopo qualche minuto ne abbiamo rilevato la temperatura. Per le temperature abbiamo invece utilizzato l'incertezza strumentale di 1 °C: nel primo esperimento infatti per mascherare le interazioni ambientali abbiamo utilizzato un'incertezza maggiore di quella strumentale di 0.3°C, mentre ora lo strumento utilizzato per misurare le temperature ha un'incertezza più elevata, che a maggior ragione maschera le possibili variazioni dovute all'ambiente.
Ø Rilevamento dati
massa = ( 135 2 ) g
temperatura t1= ( 18 1 ) °C
massa = ( 248 2 ) g.
temperatura t2= ( 70 1 ) °C
Temperatura di equilibrio ( 53 1 ) °C
D t1 = ( teq- t1 ) = ( 34 2 ) °C
D t2 = (t2 - t eq) = ( 19 2 ) °C
Come si può vedere, esiste una relazione tra la massa dell'acqua ed il salto termico, poiché dove c'era più massa, l'acqua calda ( 248 2 ) g , c'è stato una variazione di temperatura di soli ( 17 2 ) °C, rispetto all'aumento di ( 34 2 ) °C dei (18 1 ) °c dell'acqua fredda.
Posso ipotizzare una relazione tra massa e il salto termico, più precisamente una proporzionalità inversa, per cui il prodotto massa * salto termico sarà costante.
m1*Dt1= m2*Dt2
0,3)*103 °Cg
0,5)*103 °Cg
Le misure compatibili entro le incertezze, quindi potremmo ripetere la prova e constateremmo probabilmente che si tratta di una proporzionalità inversa.
Se isoliamo con passaggi algebrici la temperatura d'equilibrio otteniamo:
m1*(teq- ti)=m2*(t2-teq)
m1teq- m1ti=m2t2- m2teq
m1teq+ m2teq m1ti= m1ti +m2t2
teq (m1 +m2)= m1ti +m2t2
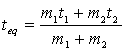
Questa formula vale comunque per
masse della stessa sostanza .
Se usassimo m1 = m2 , ritorneremmo a
teq = ( t1+t2 ) / 2
che si tratta della media, trattata nel primo esperimento .
In questo caso parleremo invece di una media pesata , dove il peso è dato dalla massa, quindi la temperatura di equilibrio sarà più vicina a quella di massa maggiore.
Calcoliamo se i dati soddisfano la relazione:
(135
![]()
teq = =(52 3)°C
(135
Come si può vedere, la temperatura di equilibrio calcolata con la formula è compatibile con quella ottenuta nel nostro esperimento, quindi possiamo dire che esiste realmente una relazione tra massa e incremento di temperatura, e che gli eventuali errori di procedimento siano compresi entro le incertezze. L'ambiente ha quindi assorbito una quantità di calore irrilevante nelle nostre misure.
Æ Terzo esperimento
Ø Scopo dell'esperimento
Con quest'esperimento intendiamo misurare la temperatura d'equilibrio fra masse uguali della stessa sostanza, a diversi stadi d'aggregazione della materia.
I parametri in gioco sono dunque:
temperature iniziali diverse
stati di aggregazione diversi (solido e liquido)
masse uguali
stessa sostanza.
Ø Materiale:
Termometro digitale con risoluzione di 1 °C e fondoscala di 150 °C;
Bilancia digitale con risoluzione variabile ( usata una risoluzione di 1g )e fondoscala di 6000g
Calorimetri;
Acqua a ( 0 1 ) °C
Ghiaccio a (19 1 ) °C
Acqua a ( 19 1 ) °C
Acqua a 80 1 °C
Ø Procedimento operativo
Nel primo calorimetro abbiamo mescolato uguali quantità di acqua a temperatura ambiente e acqua più fredda , mentre nel secondo abbiamo posto le stesse quantità di acqua a temperatura ambiente e di ghiaccio (acqua allo stato solido).
Successivamente abbiamo mescolato in un terzo calorimetro acqua che avevamo precedentemente riscaldato ( utilizzando le resistenze elettriche ) e ghiaccio, per i motivi esposti nelle osservazioni.
Dopo avere atteso diversi minuti, abbiamo rilevato la temperatura di equilibrio
Ø Rilevamento dati
Calorimetro 1
massa: (57 2)g
temperatura: (19 1)°C
massa: (57 2)g
temperatura: (0 1)°C
teq= (11 1)°C
Calorimetro 2
massa: (57 2)g
temperatura: (19 1)°C
massa: (57 2)g
temperatura: (0 1)°C
teq= (1 1)°C
Ø Osservazione dei dati
Abbiamo notato che, mentre nel primo calorimetro la temperatura di equilibrio è compatibile con la media algebrica, come ci aspettavamo, nel secondo calorimetro la temperatura di equilibrio è rimasta a 1 °C, e non si avvicina minimamente alla media tra le due temperature, come avevamo supposto, e il ghiaccio rimane tale anche dopo molto tempo e non diventa acqua.
Per spiegare questo fatto abbiamo pensato che centrasse in qualche modo il passaggio di stato del ghiaccio.
Infatti, come sappiamo da precedenti esperienze, il ghiaccio utilizza parte del calore fornitogli dall'acqua a (19 1)°C per
passare di stato ( e in questo caso la temperatura si stabilizza fino al completo passaggio di stato )
riscaldare l'acqua da 0 °C fino alla teq
in parte si disperde nell'ambiente, nel termometro e nel calorimetro.
Siccome in questo caso la temperatura si è fermata prima di quella ipotizzata d'equilibrio , vorrà dire che il calore ceduto non era abbastanza per fondere il ghiaccio e raggiungere la temperatura di equilibrio.
Per verificare che sia veramente a causa del poco calore ceduto che la temperatura si è fermata a ( 1 1 )°C, abbiamo rifatto l'esperimento con ghiaccio e acqua a (80 1) °C, più calda della precedente, e che cederà presumibilmente più calore, perché la differenza di temperatura tra i due corpi è maggiore della precedente.
Acqua:
massa: (100 2)g
temperatura: (80 1)°C
Ghiaccio:
massa: (100 2)g
temperatura: (0 1)°C
teq: (6 1)°C
Ø Osservazione dei dati e conclusioni:
Abbiamo così osservato che la temperatura di equilibrio è già aumentata a (6 1)°C. Questo significa che il ghiaccio ha utilizzato il calore fornito per il passaggio di stato, e ne è rimasto in parte anche per alzare la temperatura. Nel secondo calorimetro invece il calore fornito dall'acqua a (19 1)°C non è bastato nemmeno per il passaggio da solido a liquido.
Æ Quarto esperimento
Definizione di calore noto:
Due quantità di calore sono uguali quando producono uguali incrementi di temperatura in masse uguali di sostanze uguali, lontano da passaggi di stato.
Ø Scopo:
Partendo dalla definizione enunciata qui sopra, cerchiamo uno strumento in grado di fornirci quantità di calore note.
I parametri in gioco sono dunque:
masse uguali
temperature iniziali diverse
sostanze uguali
Ø Materiale:
Termometro con risoluzione di 1 °C e fondoscala di 150 °C;
Un riscaldatore elettrico per fornire calore alla massa (dato che il bunsen subisce facilmente sbalzi)
Un cronometro con risoluzione di 0,01 secondi
Acqua a ( 19 1 ) °C
Acqua a ( 36 1 ) °C
Ø Procedimento operativo
Abbiamo preso uguali quantità di acqua a diverse temperature e abbiamo immerso un resistore in entrambe, poiché andando per immersione otteniamo un riscaldamento più omogeneo.
Se otteniamo salti di temperatura uguali, abbiamo trovato uno strumento che, usato per un certo tempo, dà una quantità uguale di calore.
Abbiamo predefinito un tempo praticamente comodo, e trascorso quello, misurandolo con il cronometro, abbiamo rilevato le due temperature e confrontato gli incrementi di temperatura, che devono essere abbastanza grandi, perché le incertezze restino significative, ma non troppo grandi, perché inizierebbe a disperdersi calore nell'ambiente.
Ø Raccolta dati
|
Massa (g) |
Tempo durante il quale fornisco calore (sec.) |
Temperatura iniziale (°C) |
Temperatura finale (°C) |
Salto di temperatura (°C) |
|
|
|
|
|
|
|
|
|
|
|
|
Abbiamo osservato che all'interno del contenitore vi era della condensa, determinata dalla grande differenza di temperatura tra sostanza e ambiente.
Come si può vedere, gli incrementi di temperatura su masse uguali della stessa sostanza, l'acqua, sono compatibili, poiché abbiamo un incremento di (18 2)°C nel primo caso e di (16 2)°C nel secondo. Possiamo quindi affermare di aver trovato uno strumento, costituito da resistore + cronometro, che fornisce quantità di calore costanti qualunque sia l'intervallo di tempo e la temperatura iniziale.
Potremmo raddoppiare il tempo per vedere se anche l'incremento di temperatura raddoppia, definendo così che il calore fornito è costante anche in diversi intervalli di tempo, cosa che noi daremo per scontata.
Se volessimo tarare questo ipotetico strumento, metteremmo una quantità di calore arbitraria ogni 45 secondi.
Æ Quinto esperimento
Ø Scopo:
Utilizzando lo stesso strumento dell'esperimento precedente, costituito da RESISTORE + CRONOMETRO, e fornendo quindi uguali quantità di calore, cediamo quantità costanti di calore a masse diverse della stessa sostanza, studiandone gli incrementi di temperatura.
I parametri in gioco sono dunque:
masse diverse
temperature iniziali diverse
sostanze uguali
calore fornito uguale
Ø Materiale occorrente:
Termometro analogico con risoluzione di 1°C
2)g di acqua
Thermos
Resistore
Cronometro con risoluzione di 0,01s (da noi usato a 1s)
Ø Descrizione dell'esperimento:
Utilizzando i dati dell'esperimento precedente, abbiamo ceduto quantità uguali di calore a masse diverse d'acqua.
Abbiamo quindi posto in un calorimetro una quantità d'acqua all'incirca doppia di quella dell'esperimento precedente, tarando come al solito la bilancia prima di riempire il contenitore. Abbiamo poi fornito calore all'acqua con lo stesso resistore e lo stesso cronometro, per l'intervallo di tempo di (45 1) secondi, leggendo poi la temperatura finale.
Ø Rilevamento dei dati
|
Massa (g) |
Tempo durante il quale fornisco calore (sec.) |
Temperatura iniziale (°C) |
Temperatura finale (°C) |
Salto di temperatura (°C) |
|
|
|
|
|
|
|
|
|
|
|
|
Ø Osservazione dei dati
Possiamo facilmente notare che il salto di temperatura diminuisce all'aumentare della massa, quindi calcoliamo i prodotti massa*salto termico:
0,4)*103 °C*g
0,7)*103 °C*g
Anche in questo caso, fornendo calore costante a masse diverse, scopriamo una correlazione (e più precisamente una proporzionalità inversa) tra massa e incremento di temperatura.
Æ Sesto esperimento
Ø Scopo dell' esperimento:
Vogliamo misurare il salto termico dopo aver ceduto quantità di calore uguali a masse uguali di sostanze diverse utilizzando lo strumento resistore+cronometro.
I parametri sono quindi:
Stessa quantità di calore ceduto
Masse uguali
Sostanze diverse
Temperature iniziali diverse
Ø Materiale:
Paraflu (170 2)g
Olio di semi di girasole
Acqua(170 2)g
Alcool (170 2)g
Polvere di ferro (170 2)g
Un resistore (o più)
Bilancia digitale con risoluzione di 1g e fondoscala di 6000g
Cronometro+resistore
4 calorimetri
1 becher
termometro con risoluzione di 1°C
Ø Procedimento operativo
Ø Raccolta dati
|
Sostanza |
t iniziale 1°C |
T finale 1°C |
Dt 2°C |
|
Paraflu |
|
|
|
|
Acqua |
|
|
|
|
Alcool |
|
|
|
|
Olio |
|
|
|
|
Polvere di ferro |
|
|
|
La temperatura finale della polvere di ferro non va presa come dato finale vero e proprio perché, per evitare che essa superasse il fondoscala, abbiamo tolto il termometro prima che trascorressero il (45 1)s.
Ø Osservazione dei dati e conclusioni
Si può notare che per l'acqua, l'olio e il paraflu gli incrementi di temperatura siano compatibili entro le incertezze. Con la logica possiamo capire che il dato del paraflu è sbagliato perché esso ha la funzione di liquido refrigerante nelle automobili, e dovrebbe quindi avere un incremento di temperatura minore a parità di calore. Ipotizziamo quindi che esso sia scaduto.
Si può notare che l'olio ha un incremento di temperatura più alto di quello di acqua ed alcool (escludiamo il paraflu dopo le precedenti considerazioni), con un Dt di (31 2)°C rispetto a quello di circa (20 2)°C delle altre due sostanze. Il ferro poi a parità di calore ceduto ha un incremento di temperatura enormemente più alto di quello delle altre sostanze, di oltre (59 2)°C.
Visto che le diverse sostanze con masse uguali hanno incrementi differenti di temperatura, chi più nettamente, chi meno, possiamo ipotizzare che il rapporto tra il calore Q scambiato da una massa m ed il prodotto tra massa ed incremento di temperatura Dt sia una proprietà caratteristica della materia:
![]()
Per quanto riguarda l'alcool, probabilmente il suo incremento di temperatura era compatibile con quello dell'acqua perché il calore specifico è così vicino a quello dell'acqua che la differenza non è apprezzabile con i nostri strumenti.
Partendo dal comportamento della polvere di ferro, possiamo dire che essa avrà un calore specifico minore, per mantenere l'uguaglianza con un così alto salto termico. Questa osservazione si può dedurre anche dalla vita quotidiana: è infatti palese che i metalli conducono calore e si riscaldano molto velocemente rispetto a liquidi come l'acqua.
Æ Settimo esperimento
Ø Scopo dell'esperimento:
Mescolate due masse uguali di sostanze diverse alla stessa temperatura, ne vediamo la temperatura d'equilibrio.
I parametri in gioco sono dunque:
Masse uguali
Temperature iniziali uguali
Sostanze diverse
Ø Materiale:
Acqua
Alcool
Termometro analogico con risoluzione di 1 °C e fondoscala di 150°C
Bilancia digitale (da noi utilizzata con risoluzione a 1 g)
Calorimetro
Caraffa
Ø Procedimento operativo:
Abbiamo posto il calorimetro sulla bilancia , la abbiamo tarata (determinando anche in questo caso un'incertezza sui pesi di 2g), e vi abbiamo versato una quantità di acqua, poi, dopo aver nuovamente tarato, abbiamo aggiunto una pari massa di alcool. Abbiamo successivamente letto la temperatura della miscela.
Poiché le temperature di partenza e le masse sono uguali, ci aspettiamo che anche la temperatura finale non vari.
Ø Rilevamento dei dati:
Acqua :
massa (38 2) g
temperatura (21 1)°C
Alcool :
massa (38 2) g
temperatura (21 1)°C
Teq : (27 1) °C
Ø Osservazione dei dati e conclusioni:
Si può notare che la temperatura finale di (27 1)°C è totalmente diversa da quella che avevamo ipotizzato. È infatti aumentata, mentre ci aspettavamo che rimanesse stabile sui (21 1)°C. Cosa è successo?
Evidentemente, mescolandole, è avvenuta qualche reazione chimica tra le due sostanze, che ha sprigionato calore ed ha fatto aumentare la temperatura.
b Conclusioni generali:
Dopo questa serie di esperimenti, possiamo concludere che ogni parametro evidenziato nell'introduzione è influente nella temperatura finale.
Se abbiamo pari masse della stessa sostanza con temperature iniziali differenti, la temperatura di equilibrio è data dalla media aritmetica (esperimento 1).
Questa formula vale però se non vi sono passaggi di stato, durante i quali la temperatura si arresta (esperimento 2).
Se oltre alle temperature sono diverse anche le masse, si utilizza la media pesata perché la massa ha un ruolo determinante sulla temperatura finale (esperimento 3).
Dopo aver trovato uno strumento capace di fornirci quantità costanti di calore (esperimento 4) lo abbiamo sfruttato per fornire uguali quantità di calore per lo stesso intervallo di tempo, concludendo che l'incremento di temperatura è inversamente proporzionale alla massa (esperimento 5) e che il calore scambiato, rapportato al salto termico e alla massa è una costante caratteristica di ogni sostanza, denominato calore specifico (esperimento 6). Queste formule valgono non solo se non ci sono passaggi di stato, ma anche se non avvengono reazioni chimiche tra le sostanze (esperimento 7).
Tutto ciò che è stato descritto vale sempre sull'ipotesi di lavoro che tutto il calore scambiato passi da un corpo all'altro e non si disperda nell'ambiente o venga assorbito dall'apparecchiatura, naturalmente entro le incertezze.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta