| chimica |
|
|||||
|
Come elemento del IV gruppo il C ha scarsa tendenza a formare ioni, sia positivi che negativi e per tanto i suoi legami saranno di tipo covalente. Nei composti organici il C è tetravalente, salvo eccezioni rarissime.
Il capostipite degli idrocarburi è il metano CH4 nel quale è dimostrato che il C si trova al centro di un tetraedro regolare ai cui vertici sono sistemati gli atomi d'H [1] Sul foglio si può rappresentare con le forme [2] [3] in cui si conviene che i legami a tratto continuo giacciano sul piano del foglio, quelli tratteggiati entrino nel foglio allontanandosi dall'osservatore, quelli a cuneo siano diretti verso l'osservatore. Rappresentazione [4] è una formula di struttura semplificata che non si pone problemi sul reale assetto spaziale della molecola. (Piramide a tre facce, nel punto centrale è posto un C)
H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C
C
![]()
![]()
![]()
![]() H H
H H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
H
H
![]()
![]()
![]() si allontana
si allontana
![]()
![]()
![]() H C H
H C H
 in rilievo
in rilievo
H
[2]
H
![]()
![]()
![]()
![]()
![]()
![]() H C H
H C H
![]()
![]()
![]()
![]()
H
![]() H
H
![]()
![]() H C H
H C H
![]()
H
Perché i legami C - H sono tra loro indistinguibili e diretti secondo i vertici di un tetraedro? La conurazione elettronica del C nello stato fondamentale (1 s2 ,2 s2 , 2 p1x ,2 p1y ) presenta un C bivalente , disposto a mettere in tecipazione gli elettroni che da soli occupano un orbitale
(2p1x ,p 1y).
Si potrebbe pensare che il C assuma una conurazione di valenza (1 s2 ,2 s1 , 2 p1x ,2 p1y p1z ) in cui un elettrone passa da 2s a 2pz, venendo così ad avere la possibilità di formare due legami in più, ma tali legami sarebbero distinguibili (un orbitale s e tre orbitali p).
TABELLA (1)
![]()
![]()
![]()
Coke
![]()
![]() distillazione Gas
distillazione Gas
Catrame
![]() Carboni Gas
d'aria
Carboni Gas
d'aria
gassificazione Gas d'acqua
![]() Gas
misto
Gas
misto
![]() idrogenazione Idrocarburi
idrogenazione Idrocarburi
![]()
![]()
![]() Naturali Gas naturali Metano
Naturali Gas naturali Metano
in via di Alcani C2 - C3
![]()
![]() esaurimento
esaurimento
Gas
Benzine
Cherosene
Petrolio distillazione Gasolio
![]() Oli
lubrificanti
Oli
lubrificanti
Olio combustibile
Residuo
Fonti di
materie
![]()
![]() prime
prime
Glicerina
![]() Grassi e oli Sapori
Grassi e oli Sapori
Fibre sintetiche
![]()
Cellulosa
Carbone di legna
Tannini
![]() Agricole Legno Oli essenziali
Agricole Legno Oli essenziali
(rinnovabili) Trementina
Caucciù
![]()
![]() Zuccheri Alcool
Zuccheri Alcool
![]()
Alcool
Acido citrico
![]() Amido Acido lattico
Amido Acido lattico
Acido glutamminico
Interviene a questo punto un'operazione matematica di ricalcolo di questi orbitali, chiamato IBRIDIZZAZIONE, con la quale partendo da un orbitale s e tre p si ottengono 1+3=4 orbitali ibridi di tipo sp3 ,indistinguibili tra loro e disposti ad un angolo di 109 ¢(ibridizzazione tetraedrica). Queste nuvole di densità elettronica sono disposte in questo modo:

![]()
![]()
 C C
C C
[5] [6]
E vengono utilizzate nelle formazione di legami C - H per sovrapposizione con gli orbitali 1s di quattro atomi di H. Ciascuno dei quattro indistinguibili legami presenta simmetria cilindrica intorno all'asse che congiunge i nuclei dei due atomi e viene chiamato legame sigma (s). Tanti orbitali sp3 appartenenti ad atomi di C diversi possono sovrapporsi e formare lunghe catene
[C - C - C - C] - ; a legame covalente semplice C - C e la cosa lascia intravedere che i composti organici siano tanto numerosi. Che cosa succede a livello dei legami C - C ? Si consideri ora come modello l'etano[7], domandandosi se sia più verosimile rappresentarlo con la formula [8], nella quale gli H stanno alla massima reciproca distanza, o con la formula [9] derivante da una rotazione che fa perno sul legame sigma C - C , nella quale gli H sono alla minima distanza possibile.
H H
| | H
![]() H - C C - H |
H - C C - H |

![]()
![]()
![]()
![]() | | C
| | C
H H
H H
H H
C
|
H
[8]
H
![]()
![]()
![]() C
C

H H
H
![]()
![]()
![]() C
C
H H
[9]
A¢
![]() H
H
 H H
H H
![]()
![]()
![]() .
.
![]()
![]()
H H
H
B¢
H
![]()
![]() H
H

![]() H H
H H
H H
La risposta è che di etano ce n'è uno solo, in quanto non ha senso vincolare una conformazione o l'altra , o altre ancora intermedie tra le due, essendo pressoché del tutto libera la rotazione intorno al legame sigma. Le proiezioni [10]e[11] ,rappresentano in modo convenzionale ma altrettanto efficace le conformazioni [8]e[9].
Oltre all'ibridizzazione sp3 il carbonio può presentare anche quella sp2 . In tale caso si ottengono 1+2=3 orbitali ibridi di tipo sp2 che risulteranno indistinguibili e sullo stesso piano ad angolo di 120 (IBRIDIZZAZIONE TRIGONALE) mentre l'orbitale 2pz non coinvolto nell'ibridizzazione rimane inalterato e disposto normalmente al piano dei tre orbitali sp2 [12].
Un carbonio di questo tipo richiede, per la sovrapposizione degli orbitali, almeno un secondo carbonio con il quale forma un legame sigma.
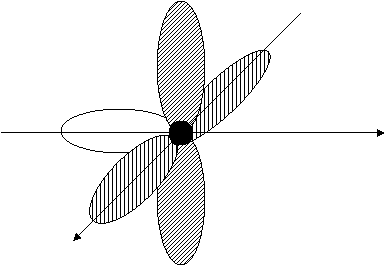
Un'ulteriore sovrapposizione fra i due orbitali 2pz forma un legame p. In [13] è schematizzata la molecola dell'etilene, in cui e il doppio legame C = C ( s p) oltre a quattro legami s
C - H.



![]()
![]()
 H π H
H π H
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]() σ
σ
![]()


![]() C C
C C
![]()
![]() σ σ
σ σ
![]()
H H
[12] [13]
![]()
![]()
![]()
![]()
![]()
![]() A A
A A
![]()
![]() A H
A H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C = C
C = C
C = C
C = C


H H H A
![]()
![]()
[15]
CIS TRANS
A differenza dell'etano il legame p porta un irrigidimento della struttura in quanto una rotazione intorno al legame C = C comporta la desovrapposizione degli orbitali 2pz, cioè la rottura del legame p. Il legame p si trova sul piano ortogonale rispetto al piano (AA CC HH), per cui la struttura[14] che ha i 2 gruppi A dalla stessa parte rispetto al piano diventa distinguibile da quella [15] in cui i sostituenti A si trovano opposti (isomeri geometrici CIS - TRANS).
La serie continua con l'ibridizzazione sp : in tale caso si formano 1+1=2 orbitali ibridi sp(ibridizzazione digonale), opposti a 180 (condizione di minima repulsione), mentre gli orbitali 2py e 2pz rimangono inalterati e disposti ortogonalmente fra loro come indicato in ura [16]. Due atomi di questo tipo formeranno un legame s C - C (sp+sp) e due legami p (2pz+2pz, 2py+2py ), portando a una molecola tipo ACETILENE
I due legami p formano una nuvola che ha simmetria cilindrica rispetto all'asse C - C [17]. Questa volta, con tutti gli atomi allineati, non ha più senso andare a vedere che cosa succeda in caso di rotazione.
![]() z
z
pY
Sp sp

x
y
PZ
[16]
![]()
![]()


[17]
H - C ≡ C - H
Nella tabella (2) che segue vengono riportate alcune caratteristiche dell'etano, dell'etilene,
dell' acetilene che mostrano che al crescere del grado di insaturazione, cioè del numero di legami
C - C, cresce l'energia di tali legami e diminuisce, oltre alla loro lunghezza, anche quella dei legami C - H .
TABELLA
|
|
FORMULE |
IBRIDAZIONE |
ANGOLI |
LEGAMI C - C (Kcal ) |
LEGAMI C - C |
LEGAMI C - H |
|
|
C2H6 |
Sp3 |
|
(semplice) |
1.54Å |
1.10Å |
|
ETILENE |
C2H4 |
Sp2 |
|
(doppio) |
1.34Å |
1.09Å |
|
ACETILENE |
C2H2 |
Sp |
|
(triplo) |
1.21Å |
1.06Å |
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta