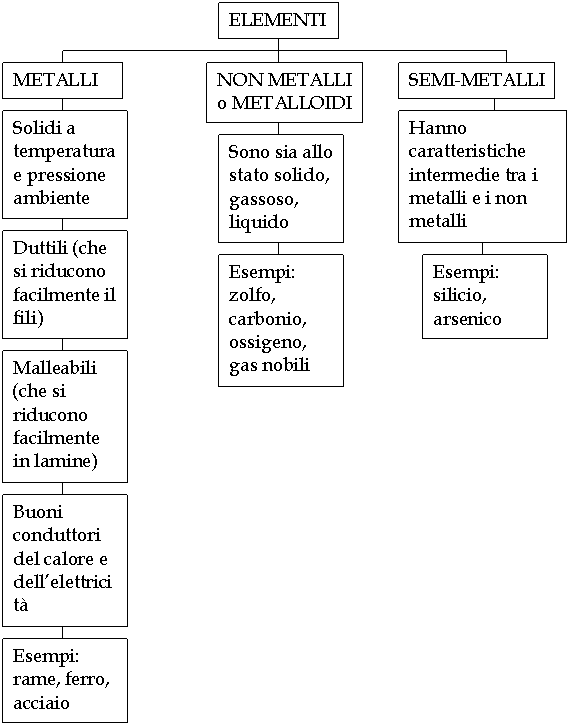
| chimica |
|
"Nulla si crea, nulla si distrugge"
LAVOISER: " in una reazione chimica la somma delle masse delle sostanze reagenti è uguale alla somma delle masse dei prodotti di reazione"
![]()
![]() C + O2 = CO2
C + O2 = CO2
Reagenti Prodotto
![]()
![]()
9g
+ 24g = 33g
PROUST: "gli elementi si combinano tra di loro secondo un rapporto in peso definito e costante"
Rame(CU) ossigeno (O)
![]() 3,97g / 1g
3,97g / 1g
![]()
![]()
per far reagire un grammo di ossigeno servono 3,97grammi di rame
![]() Quindi: 3,97/1 rapporto di combinazione
Quindi: 3,97/1 rapporto di combinazione
DALTON: "quando due elementi si combinano dando origine a più di un composto, tenendo fissa la quantità di uno di loro, i rapporti in peso dell'altro elemento sono esprimibili con numeri interi e piccoli"
Carbonio + Ossigeno = formano 2 composti diversi con diversi rapporti (3/8 - 3 /4)
Esercizio
NH3 (ammoniaca) = 17,04 g
H (idrogeno) = 3,03 g
![]() 9,15 g di H quanta NH3
9,15 g di H quanta NH3
34,63 g di N si forma? Avanza qualcosa?
N = 17,04 - 3,03 = 14,01 g
14,01 : 3,03 = 34,63 : x
![]() x = (3,03 x 34,63) / 14,01 =
7,49 g grammi di H che
reagiscono con 34,63 g di N
x = (3,03 x 34,63) / 14,01 =
7,49 g grammi di H che
reagiscono con 34,63 g di N
NH3=34,63 + 7,49=42,12 g
Quanta ne avanza? 9,15 - 7,49 = 1,66 g di H
![]() Verifica = 9,15 + 34,63 = 43,78
g 42,12 + 1,66 = 43,78 g
Verifica = 9,15 + 34,63 = 43,78
g 42,12 + 1,66 = 43,78 g
La materia è costituita da atomi, che sono la più piccola parte di un elemento.
Gli atomi di un dato elemento sono tutti uguali tra loro e possiedono la stessa massa.
Gli atomi di diversi elementi non sono tutti uguali tra loro e non possiedono la stessa massa.
Gli atomi che partecipano ad una reazione sono sempre interi e rimangono tali anche se passano da un composto all'altro.
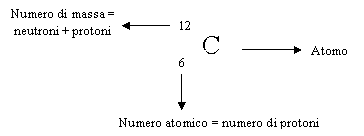
MASSA ATOMICA = numero di massa
MASSA MOLECOLARE = somma delle masse atomiche
ISOTOPI = stesso numero atomico, diverso numero di massa
Fe2O3 = (55,85 x 2) + (16 x 3)= 159,7 u (massa molecolare)
Una mole è la quantità di sostanza che contiene un numero di particelle uguali al numero di atomi contenuti in 0,012 kg dell'isotopo 12 del carbonio
Una mole di molecole di una data sostanza corrisponde ad una quantità pari alla massa molecolare relativa espressa in grammi.
1 mole di ferro corrisponde a 55,85 grammi
1 mole di calcio corrisponde a 40,08 grammi
1 mole di acqua corrisponde a 18,02 grammi
1 mole di glucosio corrisponde a 180,18 grammi
Corrispondente
in grammi della massa molecolare.
![]() MOLE = è il rapporto della
massa in grammi fratto la massa molare
MOLE = è il rapporto della
massa in grammi fratto la massa molare
![]()
n = m [g] / M [g/mol]
![]() NUMERO di AVOGADRO=1/1,66 x 10^-24=6,023 x 10^23 =
numeri di atomi in una mole
NUMERO di AVOGADRO=1/1,66 x 10^-24=6,023 x 10^23 =
numeri di atomi in una mole
Massa di un' unità di u
602300 miliardi di atomi di Pb -> massa in g
6,023 x 10^14
Pb -> 207,2 u
Mole = 6,023 x 10^14 / 6,023 x 10^23 = 1 x 10^ -9
![]() n = m [g] / M [g/mol] m[g]=n [mol]
x M[g/mol]
n = m [g] / M [g/mol] m[g]=n [mol]
x M[g/mol]
m=1x 10^ -9 mol x 207,2 g/mol= 2,072 x 10 ^ -7 mol
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta