| chimica |
|
LEGAME CHIMICO E POLARITA'
Obiettivo: determinare la polarità (polare, poco polare o apolare) in base al legame chimico dei tre solventi presi in considerazione, ovvero acqua, alcool etilico e cicloesano, in funzione all'avvicinamento di una bacchetta di plexiglas caricata positivamente e della solubilità di alcuni soluti in questi tre liquidi.
I° PARTE
Ø Acqua distillata (H2O);
Ø Alcool etilico (CH3CH2OH);
Ø Cicloesano (C6H6).
Strumenti:
Ø Buretta;
Ø Bacchetta di plexiglas;
Ø Panno di lana.
Procedura:
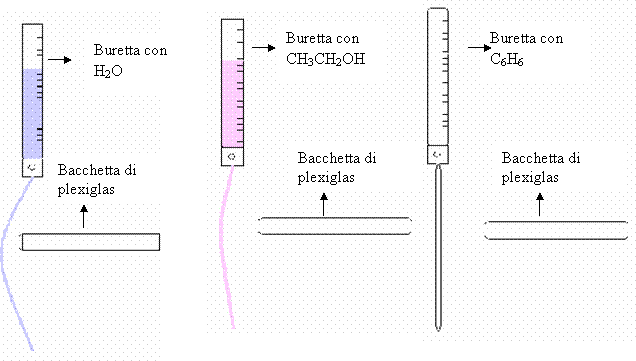
Ø Versare all'interno della buretta una quantità a scelta di acqua;
Ø Sfregare e strofinare, utilizzando un panno di lana, una bacchetta di plexiglas, in modo da elettrizzarla positivamente;
Ø Aprire il rubinetto della buretta, e assicurarsi che l'acqua scenda a filo;
Ø Avvicinare la bacchetta al filo d'acqua, e osservare ciò che accade;
Ø Ripetere gli stessi passaggi, utilizzando anche alcool etilico e cicloesano;
Ø Raccogliere infine tutti i dati in una tabella.
Accorgimenti:
Ø Assicurarsi che il liquido presente nella buretta scenda a filo, in modo da poter verificare il suo comportamento in funzione dell'avvicinamento della bacchetta;
Ø Effettuare, per ragioni di sicurezza, sotto cappa i passaggi riguardanti il cicloesano, in quanto sostanza cancerogena.
Rappresentazione iconica dell'esperienza:
Rielaborazione e raccolta dati:
|
|
Acqua |
Alcool etilico |
Cicloesano |
|
A contatto con la bacchetta |
Si nota una deflessione del getto molto evidente |
Si nota una piccola deflessione del getto |
Non si nota alcuna deflessione |
II° PARTE
Materiali:
![]()
Ø
SOLUTI
Acqua distillata (H2O);
Ø Alcool etilico (CH3CH2OH);
Ø Cicloesano (C6H6).
Ø
![]() KOH (idrossido di potassio);
KOH (idrossido di potassio);
Ø
SOLVENTI
NaCl (cloruro di
sodio);
Ø I2 (iodio);
Ø C12H22O11 (saccarosio);
Ø C10H8 (naftalene).
Strumenti:
Ø 15 provette;
Ø Un porta provette;
Ø Vetrini da orologio, contenenti ognuno un soluto in forma solida;
Ø Tre becker contenenti i solventi;
Ø Pipetta;
Ø Bacchetta.
Procedura:
Ø Prendere il becker contenente l'acqua e riempire 5 provette, inserendo una quantità di liquido pari a circa due dita;
Ø Aggiungere in ogni provetta, uno dei solventi sopra elencati;
Ø Agitare la provetta per qualche minuto e successivamente osservare ciò che succede;
Ø Ripetere tutti i passaggi sopra elencati anche per alcool etilico e cicloesano;
Ø Raccogliere infine tutti i dati in una tabella;
Accorgimenti:
Ø Operare sotto cappa durante i passaggi riguardanti il cicloesano, in quanto sostanza cancerogena;
Ø Riempire ogni provetta con una quantità di liquido pari a circa due dita;
Ø Agitare la provetta per qualche minuto in modo da sollecitare lo scioglimento del sale;
Ø Utilizzare una bacchetta per mescolare la soluzione, in modo da velocizzare lo scioglimento del sale.
Elaborazione e raccolta dati:
|
DATI |
H2O |
CH3CH2OH |
C6H6 |
|
KOH |
È solubile in acqua |
La soluzione assume un colore giallastro e il KOH si scioglie |
Non solubile |
|
I2 |
Non solubile e va a depositarsi sul fondo della provette |
È solubile, e la soluzione assume un colore rosso molto intenso e scuro |
È solubile, e la soluzione assume un colore viola molto intenso e scuro |
|
NaCl |
È solubile |
Parzialmente solubile |
Non solubile |
|
C12H22O11 |
È solubile |
Poco solubile |
Non solubile |
|
C10H8 |
Non solubile e galleggia sul liquido |
È parzialmente solubile |
È solubile |
Osservazioni e conclusioni:
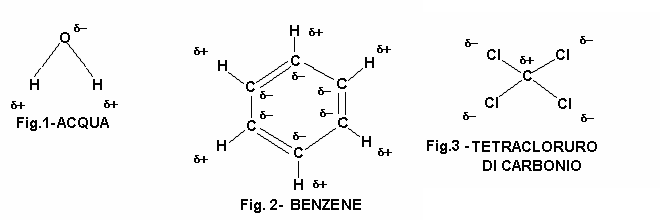
Con quest'esperienza si è voluto determinare la polarità, in base al legame chimico, di tre liquidi, ovvero acqua alcool etilico e ciclo esano.
Dai risultati dell'esperienza, si è determinato che l'acqua ha un legame chimico polare, il cicloesano apolare e l'alcool etilico poco polare, perché ha caratteristiche miste. La molecola dell'acqua è, infatti, un dipolo con una zona ad addensamento di carica positiva dalla parte dei due atomi di idrogeno, ed una ad addensamento di carica negativa dalla parte dell'atomo di ossigeno; a causa di questa conurazione essa risente della presenza di un campo magnetico. La molecola del benzene non è dipolare. Infatti, pur essendo il legame C-H del tipo covalente polare, la struttura regolare della molecola fa sì che il baricentro delle cariche si trovi al centro geometrico della struttura, annullando l'effetto di tali cariche. Per quanto riguarda l'alcool etilico, esso presenta nella sua molecola un gruppo -OH che consente una attività di solvente polare ed una parte idrocarburica CH3-CH2- che ne conferisce attività anche di solvente non-polare, ed è per questa ragione che riscontriamo comportamenti misti da parte di questo composto.
Osserviamo ora i dati della tabella:
Nell'acqua si sciolgono KOH, in quanto sostanza ionica grazie al gruppo OH-, formatasi da un legame ionico, NaCl, in quanto composto ionico, formatosi con un legame ionico e saccarosio, in quanto sostanza capace di interagire con la molecola dell'acqua creando legami ad idrogeno.
I2 e naftalene non si sciolgono, in quanto sostanze apolari;
Nell'alcool etilico si sciolgono totalmente sia sostanze ioniche come KOH che sostanze apolari come I2 e naftalene, mentre si scioglie parzialmente il cloruro di sodio e non si scioglie il saccarosio; questo è dovuto alla conurazione della molecola dell'alcool, che fa sì, come ho già detto prima, che la sostanza abbia caratteristiche sia polari che non polari.
Nel cicloesano si sciolgono I2 e naftalene, in quanto sostanze apolari, mentre non si sciolgono le sostanze polari, quali KOH, NaCl e saccarosio.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta