| chimica |
|
|||||
|
L'ELETTROLISI DELL'ACQUA
MATERIALE
H O (Acqua distillata);
H SO (Acido Solforico);
Sistema di vasi comunicanti: voltametro di Hoffman;
Generatore di energia ed elettrodi in carbone.
Becker
Fiammiferi
PROCEDIMENTO
Preparare una soluzione al 20% di Acido Solforico e acqua; successivamente, dopo aver collegato gli elettrodi al voltametro di Hoffman, versare la soluzione preparata precedentemente nel sistema di vasi comunicanti e collegare gli elettrodi al generatore con una corrente di 12 volt.
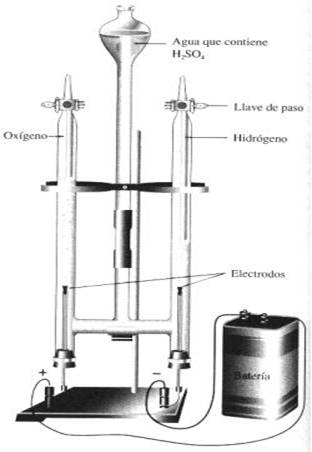
CONCLUSIONE
L'elettrolisi dell'acqua è un processo elettrolitico nel quale il passaggio di corrente elettrica causa la decomposizione dell'acqua in ossigeno ed idrogeno gassosi
![]() 2H O+
2e¯ H +
2OH¯ (Catodo)
2H O+
2e¯ H +
2OH¯ (Catodo)
![]() 2H O O + 4H +
4e¯ (Anodo)
2H O O + 4H +
4e¯ (Anodo)
![]()
![]() 2H O 2H O
2H O 2H O
Al CATODO: avviene la reazione di RIDUZIONE; infatti gli ioni idrogeno acquistano elettroni e viene prodotto idrogeno gassoso.
Al ANODO: avviene la reazione di OSSIDAZIONE; gli ioni idrossido subiscono ossidazione e cedono elettroni producendo ossigeno gassoso.
Dalla reazione e dalla stessa esperienza di può notare che si formerà un volume di idrogeno doppio del volume di ossigeno.
Abbiamo inoltre notato che l'idrogeno è un combustibile in quanto ponendo un fiammifero acceso all'estremità aperta del vaso contenente idrogeno gassoso la fiamma aumenta ed è possibile sentire uno scoppiettio. Al contrario non accade nulla se il fiammifero è posto in presenza di ossigeno gassoso perché questo è solamente un comburente ed è quindi utilizzato per facilitare la combustione
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta