| chimica |
|

L'acqua è il liquido più comune sulla terra ed ha un ruolo fondamentale per la vita degli esseri viventi.
 Pur essendo così comune, solo
qualche secolo fa si è scoperta la sua composizione chimica e si sono comprese
le sue proprietà fisiche.
Pur essendo così comune, solo
qualche secolo fa si è scoperta la sua composizione chimica e si sono comprese
le sue proprietà fisiche.
L'acqua è una sostanza composta, la cui
molecola è formata da due atomi di idrogeno e un atomo di ossigeno, legati tra loro mediante un legame covalente polare: la formula è quindi H2O.
Le molecole dell'acqua hanno due poli: uno negativo (-) quello dell'ossigeno e uno positivo (+). Più molecole d'acqua si legano tra loro con il ponte ad idrogeno. Questo particolare legame conferisce a questa sostanza delle proprietà particolari.
DENSITA'
Di norma la densità di una sostanza varia con la temperatura: se la temperatura di un corpo aumenta, diminuisce il volume e aumenta la densità di questo.
Nel caso dell'acqua, però avviene il contrario: l'acqua allo stato liquido ha densità massima a 4°C, mentre a 0°C, quando solidifica, ha densità minore dell' acqua liquida a 4°C, con ciò possiamo spiegare anche il fatto che il ghiaccio galleggi sull'acqua. Questo comportamento anomalo dell'acqua comporta un notevole vantaggio, specialmente per gli esseri viventi che sono costretti a vivere in ambienti di acqua dolce anche con temperature basse; infatti, se l'acqua avesse lo stesso comportamento delle atre sostanze, i laghi ghiaccerebbero completamente, facendo morire tutti gli esseri viventi presenti.
POTERE SOLVENTE
Strofinando un panno di lana su una bacchetta di vetro o di bachelite, abbiamo osservato che se avvicinavamo questi oggetti (caricati elettricamente) a dei pezzettini di carta, questi ultimi venivano attratti. La bacchetta di vetro aveva carica positiva, mentre la bacchetta di bachelite possedeva carica negativa.
 Se dopo aver caricato la bacchetta elettricamente veniva avvicinata ad
un sottile flusso d'acqua, questo si avvicinava alla bacchetta, orientando gli
ossigeni dalla parte della bacchetta se quest'ultima era caricata
positivamente, mentre orientava gli idrogeni se la bacchetta aveva carica
negativa, causando la formazione di un dipolo (d). Se invece le bacchette
venivano avvicinate ad un flusso di benzina non accadeva nulla.
Se dopo aver caricato la bacchetta elettricamente veniva avvicinata ad
un sottile flusso d'acqua, questo si avvicinava alla bacchetta, orientando gli
ossigeni dalla parte della bacchetta se quest'ultima era caricata
positivamente, mentre orientava gli idrogeni se la bacchetta aveva carica
negativa, causando la formazione di un dipolo (d). Se invece le bacchette
venivano avvicinate ad un flusso di benzina non accadeva nulla.
Questo fenomeno è dovuto alla natura polare dell'acqua e a quella apolare della benzina (tipica degli idrocarburi).
Successivamente abbiamo messo del sale da cucina (cloruro di sodio NaCl) all'interno di una provetta contenente dell'acqua; abbiamo osservato che il sale si scioglieva, cosa che non accadeva se al posto dell'acqua c'era della benzina. Ciò significa che l'acqua è un solvente polare che di conseguenza scioglie solo sostanze polari.
In secondo luogo abbiamo introdotto dello iodio (I=I), sostanza apolare nelle medesime sostanze, lo iodio si scioglieva solamente nella benzina, mentre nella provetta che conteneva l'acqua non succedeva nulla. Questo fenomeno è dovuto al fatto che la benzina, essendo un solvente apolare, scioglie solo sostanze apolari.
TENSIONE SUPERFICIALE
L'acqua possiede un'elevata tensione superficiale, osservabile tramite la formazione di gocce, proprietà anch'essa importante per la vita. Essa è una sorta di "pellicola" che sostiene i corpi appoggiati in superficie con forza considerevole. Infatti l'acqua possiede una particolare elasticità dello strato superficiale dovuta alla forza di attrazione reciproca delle molecole che risulta sbilanciata verso il basso nella parte a contatto con l' aria.
Nel nostro laboratorio abbiamo osservato questo fatto appoggiando una lamina d'acciaio di taglio o sulla superficie dell'acqua. Nel primo caso la lamina affondava, mentre nel secondo galleggiava. Se oltre all'acqua venivano aggiunti del sapone o alcol, i corpi affondavano perché la tensione superficiale si allentava.
In natura si può osservare questo fenomeno negli insetti come le zanzare, che pur appoggiandosi su uno specchio d'acqua non affondano.
FORZA DI ADESIONE
Se introduciamo una modesta quantità d'acqua in un contenitore di teflon, si nota che essa non si distribuisce uniformemente in tutto il contenitore, bensì ha la tendenza ad accumularsi in una specifica zona del recipiente. Ciò non accade con il vetro, in cui abbiamo il comportamento contrario. Questo succede perché le forze di adesione cambiano a seconda del materiale con cui l'acqua viene a contatto. Abbiamo un comportamento idrofilo con le sostanze polari e idrofobo con quelle apolari.
Si può osservare questo fenomeno in natura quando immergiamo un oggetto in acqua e lo estraiamo bagnato.
CAPILLARITA'
Insieme dei fenomeni fisici prodotti dalle forze adesive e coesive e dalla tensione superficiale, che si verificano fra un liquido e un solido lungo la superficie di separazione.
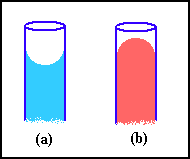 Si nota che l'acqua tende a salire in vicinanza delle pareti di un
bicchiere di vetro. Questo avviene perché le molecole di questo liquido hanno
una forte tendenza ad aderire al vetro. I liquidi che bagnano le pareti formano
superfici concave (es: acqua/vetro(a)), quelli che
non le bagnano formano superfici convesse (es:
mercurio/vetro (b)). Nei tubi di diametro interno inferiore a 2 mm, chiamati
capillari, un liquido bagnabile forma un menisco concavo nella sua superficie
superiore e tende a risalire lungo il tubo. Al contrario, un liquido non
bagnabile forma un menisco convesso e tende invece a scendere. La quantità di
liquido richiamata nel capillare aumenta finché le forze che lo attirano non
raggiungono l'equilibrio con il peso della colonna fluida. La risalita, o la
discesa, dei liquidi nei tubi sottili è chiamata capillarità. Anche la capillarità è
governata dalle forze di coesione e di adesione.
Si nota che l'acqua tende a salire in vicinanza delle pareti di un
bicchiere di vetro. Questo avviene perché le molecole di questo liquido hanno
una forte tendenza ad aderire al vetro. I liquidi che bagnano le pareti formano
superfici concave (es: acqua/vetro(a)), quelli che
non le bagnano formano superfici convesse (es:
mercurio/vetro (b)). Nei tubi di diametro interno inferiore a 2 mm, chiamati
capillari, un liquido bagnabile forma un menisco concavo nella sua superficie
superiore e tende a risalire lungo il tubo. Al contrario, un liquido non
bagnabile forma un menisco convesso e tende invece a scendere. La quantità di
liquido richiamata nel capillare aumenta finché le forze che lo attirano non
raggiungono l'equilibrio con il peso della colonna fluida. La risalita, o la
discesa, dei liquidi nei tubi sottili è chiamata capillarità. Anche la capillarità è
governata dalle forze di coesione e di adesione.
CALORE SPECIFICO
Il calore specifico di una sostanza è la quantità di calore che serve a far variare la temperatura della stessa di 1°C.
Nel caso dell'acqua questo valore è molto elevato: 4,19 kj/kg. Questo rallenta le variazioni di temperatura, perché è necessaria molta energia perché avvenga ciò. Questo significa che anche la temperatura di ebollizione è molto elevata (100°C).
PUNTO TRIPLO
Il punto triplo di una sostanza sono la pressione e la temperatura particolari a cui le diverse fasi di una data sostanza (liquido, solido, gassoso) coesistono in equilibrio.
Il punto triplo dell'acqua è fissato a 273,16 K (cioè 0,01°C) con una pressione di 611,2 Pa
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta