| chimica |
|

Esistono due ipotesi, di modello atomico:
L'idea venne scartata successivamente, in quanto, se gli elettroni fossero a distanze casuali dal nucleo, potrebbe capitare che cadono sul nucleo, e quindi la materia non esisterebbe. Non è possibile.
Bohr riuscì a spiegare la sua teoria, grazie allo studio delle onde luminose di ck.
Infatti ipotizzo che il comportamento che hanno i raggi luminosi fossero gli stessi che hanno gli elettroni.
Secondo il PRINCIPIO DI INDETERMINAZIONE DI HEISENBERG, non è possibile conoscere con precisione e nello stesso istante la posizione e la velocità di una particella in movimento.
Quindi non si può stabilire una traiettoria precisa dell'elettrone.
Per questo, tramite statistica vengono individuate gli ORBITALI = zona dove c'è la massima probabilità della presenza dell'elettrone.
ESISTONO 4 TIPI DI ORBITALE:
S :
è


A forma sferica
P :
sono
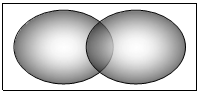

A doppio lobo
D : sono
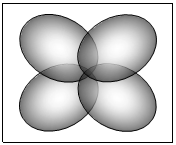


F : sono
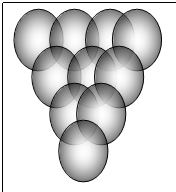

A grappolo
La disposizione degli elettroni negli
orbitali, e quella di quest'ultimi nell'atomo, è rappresentata
attraverso questo schema, che illustra appunto
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
4d
4p
4s
![]()
![]()
![]()
![]()
![]() 3d
3d
3p
3s
2p
2s
1s
Ogni quadratino corrisponde ad un orbitale. La scrittura 1s, sta a significare che ci si trova nel 1° livello, e si ha un orbitale di tipo s.
Come la scrittura 2s, significa che ci si trova nel 2° livello e si ha un orbitale di tipo s.
Lo stesso vale per le altre, per esempio la scrittura 3d, significa che ci si trova nel 3°livello e si ha un orbitale di tipo d.
In base al PRICIPIO DI ESCLUSIONE DI PAULI, si può affermare che ogni orbitale può contenere solamente due elettroni.
E in base al PRINCIPIO DI HUND, si può affermare che gli elettroni prima occupano con un solo elettrone il massimo numero di orbitali, poi se rimangono ancora elettroni, completano gli orbitali.
Quindi, ogni orbitale verrà completato da max due elettroni, che verranno rappresentati con due vettori di verso opposto.
![]()

![]()
![]()
orbitale
![]()
elettroni
Per costruire questa rappresentazione grafica è necessario conoscere il gruppo ed il periodo di appartenenza.
ES: se sappiamo che il Si (silicio) appartiene al 4°gruppo ed al 3° periodo, possiamo dedurre, che
appartenendo al 4° gruppo, avrà 4 elettroni nel livello più esterno, e appartenendo al 3° periodo
avrà come ultimo livello il 3°.
Infatti: Num. gruppo = num. elettroni nell'ultimo livello.
![]()
![]()
![]() Num. periodo = num. dei livelli.
Num. periodo = num. dei livelli.
Quindi per il silicio risulterà una rappresentazione così:
![]()
![]()
![]()
![]()
![]()
![]()
3p2
Con
questa scrittura: 1s2, si indica il livello energetico (1°), il
tipo di orbitale (s) e il numero di elettroni presenti nell'orbitale (2).
![]()
![]()
3s2
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 2p6
2p6
2s2
![]()
![]()
1s2
Per rappresentare il numero di elettroni presenti nell'ultimo livello energetico di un atomo è possibile effettuare il DIAGRAMMA ELETTRONICO A PUNTI (o formula di Lewis).
Per effettuarlo è necessario conoscere il num. di elettroni nell'ultimo livello oppure conoscere il gruppo di appartenenza dell'atomo.
Prendendo in considerazioni il Si (silicio), e sapendo che appartiene al 4° gruppo e quindi possiede 4 elettroni nell'ultimo livello, risulterà una rappresentazione così.
![]()
![]()
![]()
![]() Si
Si
Ogni punto corrisponde ad un elettrone, e anche qui, prima gli elettroni occupano tutti i 'lati' del simbolo chimico, poi continuano a coppie:
![]()
![]()
![]()
![]()
![]()
![]() O
O
Fino ad un massimo 4 coppie, cioè ad 8 elettroni.
Quando ci sono degli elettroni spaiati (da soli), tendono a formare dei legami per raggiungere l'ottetto.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta