| chimica |
|
Qualsiasi sostanza può presentarsi in uno stato:
Sostanze allo stato gassoso:
Una sostanza si dice allo stato gassoso quando le sue particelle non sono attratte tra loro, non sono legate in legami e si muovono indipendentemente le une dalle altre
I "gas ideali":
Le proprietà dei gas dipendono da:
Le trasformazioni dei gas:
![]()
![]() Trasformazione isoterma (legge di Boyle): operando a Temperatura e Nm
di Moli costanti, il prodotto dei valori di Volume e Pressione è
costante (Volume e Pressione sono inversamente proporzionali)
Trasformazione isoterma (legge di Boyle): operando a Temperatura e Nm
di Moli costanti, il prodotto dei valori di Volume e Pressione è
costante (Volume e Pressione sono inversamente proporzionali)
Pt
= P0*(1 + t/273) PT
= P273*[1 + (T-273)/273] = P273*(1 + T/273 - 273/273)
= P273* T/273
![]()
![]()
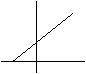

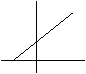
Trasformazione isobara (legge di Charles):
Operando a pressione e nm moli costanti, all'aumentare della temperatura,
il volume aumenta e precisamente all'aumentare di
![]()
![]()
g
MM
temperatura (in Kelvin) pressione volume (in Litri)![]()
![]()
![]()
![]()
![]()
![]() P * V = * R * T
P * V = * R * T

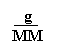
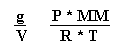
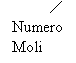
densità
![]() inoltre: n = d = =
inoltre: n = d = =
Ogni gas ha 1 temperatura, detta "temperatura critica" in cui l'Energia delle particelle è uguale all'energia dei legami che si possono instaurare tra di esse.
Esistono 2 tipi di sostanze allo stato aeriforme:
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta