| chimica |
|
La costruzione delle molecole a partire dagli atomi si può affrontare con una serie di teorie a complessità crescente:
Teoria di Lewis (1915)
Con la regola dell'ottetto, i modelli del legame ionico e omopolare, ed il legame dativo (da interpretare come un artifizio classificatorio per tener conto del numero complessivo degli elettroni presenti in una molecola, e non come corrispondente a una realtà fisica definita) è la teoria più semplice per interpretare la formazione delle molecole. La teoria dell'ottetto cade comunque in difetto con alcune atomi del terzo periodo in cui già per PCl5 o H3PO4
dobbiamo introdurre la regola del decetto
Sulla regola dell'ottetto non ci soffermiamo molto poiché reperibile in qualsiasi testo di chimica generale.
Ci limitiamo ad osservare che l'idrogeno con l'ossigeno forma l'acqua, con l'azoto, che ha cinque elettroni, forma la molecola NH3
La stechiometria di questi composti può essere prevista facilmente considerando che un atomo di idrogeno può fornire un elettrone per la formazione di un legame covalente. Il numero di atomi di idrogeno che si possono legare a un atomo dell'altro elemento è uguale alla differenza tra il numero di elettroni presenti nell'atomo dell'altro elemento e il numero otto (Si potrebbe pensare ad un angolo di legame di 90°, fra i vari atomi coordinati, ma ciò non è suffragato sperimentalmente da cui la teoria della promozione e ibridazione sp3 che permette una previsione più corretta degli angoli di legame, tipica della teoria del legame di valenza)
Nelle molecole HF, H2O, NH3, sugli elementi fluoro, azoto e ossigeno restano delle coppie non condivise che possono essere usate per formare altri legami con elementi, o ioni, che siano capaci di accettarle. Se, per esempio, si considera lo ione H+, si vede che esso ha due vacanze elettroniche nello strato di valenza e quindi può formare un legame accettando un doppietto elettronico. Così, almeno sulla carta, si possono formare le specie H2F+, H3O+, NH4+, rappresentabili dalle formule:
Conviene notare che il legame, che formalmente abbiamo descritto come formato dalla sovrapposizione di un doppietto non condiviso dell'elemento centrale con l'orbitale 1s vuoto dell'idrogeno, è in realtà indistinguibile dagli altri e nella scrittura della formula non si è in effetti usato per esso nessun segno grafico particolare. Quello che conta per la descrizione dei legami presenti in una molecola è la natura degli atomi che la costituiscono e il numero complessivo degli elettroni che le appartengono. Scrivere le formule partendo dalle conurazioni elettroniche degli atomi isolati è un artifizio utile per valutare il numero di orbitali e di elettroni complessivamente disponibili per la formazione dei legami, ma non si deve associare ad esso un significato fisico preciso. Così, per esempio, nello scrivere la formula dell'ammoniaca si potrebbe partire da un ipotetico ione N3-, avente otto elettroni esterni, e da tre ioni H+. In questo caso si potrebbe descrivere la formazione dei tre legami N-H come una donazione di tre doppietti da parte dello ione N3- ai tre ioni H+.
Talora si trova nei testi la dizione legame dativo per questo particolare legame a coppia di elettroni in cui appunto un doppietto ura come donato da un elemento a un altro. Esso va comunque interpretato come un artifizio classificatorio per tener conto del numero complessivo degli elettroni presenti in una molecola, e non come corrispondente a una realtà fisica definita.
Per sgombrare, quindi, il terreno da ogni possibilità di equivoci conviene sempre far riferimento al numero di elettroni presenti in una molecola, indipendentemente dall'atomo al quale essi possano inizialmente essere associati. Così se si vuol descrivere nuovamente e in modo diverso la formazione dei legami nell'ammoniaca, si deve tener conto che in NH3 sono presenti in tutto otto elettroni, disponibili per la formazione di legami, cinque portati dall'azoto e tre, uno per ciascuno, portati dai tre atomi di idrogeno. L'azoto nella molecola dovrà essere circondato da otto elettroni, mentre gli atomi di idrogeno dovranno essere circondati da due elettroni ciascuno. Se non ci fosse tecipazione di elettroni tra i due tipi di atomi sarebbero in tutto necessari quattordici elettroni. La differenza tra questo numero e quello degli elettroni effettivamente presenti è sei; tale numero deve rappresentare appunto il numero di elettroni tecipati tra gli atomi di azoto e di idrogeno.
Si potranno quindi formare tre legami, che per
quanto detto in , dovranno essere
tre legami di tipo covalente. Nel caso dello ione ammonio, NH4+,
il numero di elettroni complessivi è sempre otto, mentre il numero di
elettroni necessari a riempire gli strati di valenza di tutti gli atomi
è ora sedici. La differenza tra i
due numeri è in questo caso otto, corrispondente alla formazione di
quattro legami ![]() azoto-idrogeno.
azoto-idrogeno.
Per la determinazione dei legami multipli con la regola di Lewis si può ricorrere alla regola del 6N +2 che sono il n° di elettroni necessari in una molecola di N atomi (escluso l'idrogeno) per avere tutti legami semplici. Per ogni 2 elettroni in meno di questo numero si avrà un legame doppio
Esempio
a) molecola biatomica non contenete H = 6 x2 +2 = 14 elettroni
Cl2 7 x2 = 14 elettroni legame semplice
O2 6x 2 = 12 mancano due elettroni a 14 : un legame doppio
N2 , CO = 10 elettroni : un legame triplo. La cosa può sembrare strana per CO ma possiamo per ora vedere una diversa energia di legame rispetto al CO carbonilico o dell'anidride carbonica quindi qualcosa di diverso può esserci come vedremo dopo
b) Molecola triatomica 6x3 +2 =20 elettroni
CO2 4 + 6x2= 16 elettroni mancano 4 elettroni 2 legami doppi
SO2 6 + 6x2 =18 : 1 legame doppio: quale? L'energia di legame dice che sono uguali
O3: 18 elettroni: 1 legame doppio
c) Molecola tetraatomica 26 elettroni
SO3 24 elettroni: 1 legame doppio ma quale?
teoria VSEPR (Valence Shell Electron Pair Repulsion = repulsione delle coppie elettroniche nello strato di valenza)
(si serve della questione della promozione e della ibridazione degli orbitali) teoria che ha studiato la geometria delle molecole ed ha previsto che le coppie di elettroni , per repulsione si dispongano in una molecola alla massima distanza fra loro (di qui la struttura tetraedrica del metano, dello ione ammonio, dell'acqua con i doppietti sull'ossigeno)
teoria del legame di valenza (sviluppata dal 1930)
questa teoria parte dal concetto degli
orbitali atomici e porta alla formazione dei legami ![]() (nuvola elettronica di simmetria cilindrica
lungo l'asse di congiunzione fra i due atomi che si legano) e
(nuvola elettronica di simmetria cilindrica
lungo l'asse di congiunzione fra i due atomi che si legano) e ![]() (con sovrapposizione della nuvola elettronica
al di fuori dell'asse di congiunzione e che porta ad un legame sostanzialmente
più debole del precedente) Con questa teoria si introducono i concetti
di promozione ed ibridazione. (è la teoria utilizzata per spiegare il
comportamento e la struttura delle sostanze organiche perché tipica del
comportamento del carbonio). Non è però sufficiente a spiegare la
struttura del benzene come di altre sostanze da cui l'introduzione del concetto
di mesomeria o di risonanza ,
diversi modi egualmente corretti di disporre gli elettroni intorno agli atomi,
per interpretare i dati sperimentali in particolare sulle lunghezze e le
energie di legame. Con queste strutture, separate da una freccia a due punte,
non indichiamo una forma in equilibrio con l'altra , ma due (o più)
forme limite tale che la struttura reale sia un intermedio (ibrido di risonanza)
fra le forme rappresentate. Questa delocalizzazione degli elettroni porta ad
una diminuzione dell'energia potenziale chimica e pertanto ad una
stabilizzazione della molecola
(con sovrapposizione della nuvola elettronica
al di fuori dell'asse di congiunzione e che porta ad un legame sostanzialmente
più debole del precedente) Con questa teoria si introducono i concetti
di promozione ed ibridazione. (è la teoria utilizzata per spiegare il
comportamento e la struttura delle sostanze organiche perché tipica del
comportamento del carbonio). Non è però sufficiente a spiegare la
struttura del benzene come di altre sostanze da cui l'introduzione del concetto
di mesomeria o di risonanza ,
diversi modi egualmente corretti di disporre gli elettroni intorno agli atomi,
per interpretare i dati sperimentali in particolare sulle lunghezze e le
energie di legame. Con queste strutture, separate da una freccia a due punte,
non indichiamo una forma in equilibrio con l'altra , ma due (o più)
forme limite tale che la struttura reale sia un intermedio (ibrido di risonanza)
fra le forme rappresentate. Questa delocalizzazione degli elettroni porta ad
una diminuzione dell'energia potenziale chimica e pertanto ad una
stabilizzazione della molecola

![]()
Questa teoria viene quindi applicata ad alcune molecole della chimica inorganica sia per l'interpretazione del legame multiplo come il doppio legame dell'ossigeno e triplo legame dell'azoto (che però è molto più stabile del corrispondente triplo legame dell'acetilene o etino) e per sostituire il concetto del legame dativo con quello della mobilità dei doppietti elettronici fra più strutture risonanti


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Completamente simile è la struttura dello ione carbonato in cui fra l'altro la carica elettrica è distribuita in maniera uniforme sui tre atomi di ossigeno (similmente a come era distribuita la carica positiva sui quattro idrogeni dello ione ammonio)
|
Composto |
Tipo di legame |
Distanza |
energia |
|
alcano |
C-C |
|
|
|
alchene |
C=C |
|
|
|
alchino |
C |
|
|
|
|
C |
|
|
|
|
C=C C=C |
|
|
Come si vede cambiando il tipo di ibridazione,
passando da sp3, a sp2, a sp, si accorciano le distanze
di legame, per la formazione di legami multipli di tipo ![]() ,
ma per il benzene pur ibridato sp2 abbiamo distanze di legame ,
tutte uguali ed intermedie fra quelle del legame singolo e quelle del legame
doppio. L'energia di legame(36 Kcal di energia di risonanza complessivamente,
per ora non riportata in tabella perché non trovata in dati confrontabili con
quella riportata per gli altri composti) è poi tale, come si sa, da
confermare questa speciale struttura di risonanza con il doppio legame
delocalizzato. Anche il butadiene ed i
dieni coniugati sembrano partecipare (ed avremo una conferma con la teoria
degli orbitali molecolari), seppure in maniera inferiore alla delocalizzazione
del doppio legame, in particolare si vede che diminuisce la distanza del legame
semplice compreso fra i due doppi, hanno 3 Kcal di energia di risonanza, hanno
la speciale addizione 1-4.
,
ma per il benzene pur ibridato sp2 abbiamo distanze di legame ,
tutte uguali ed intermedie fra quelle del legame singolo e quelle del legame
doppio. L'energia di legame(36 Kcal di energia di risonanza complessivamente,
per ora non riportata in tabella perché non trovata in dati confrontabili con
quella riportata per gli altri composti) è poi tale, come si sa, da
confermare questa speciale struttura di risonanza con il doppio legame
delocalizzato. Anche il butadiene ed i
dieni coniugati sembrano partecipare (ed avremo una conferma con la teoria
degli orbitali molecolari), seppure in maniera inferiore alla delocalizzazione
del doppio legame, in particolare si vede che diminuisce la distanza del legame
semplice compreso fra i due doppi, hanno 3 Kcal di energia di risonanza, hanno
la speciale addizione 1-4.
|
composto |
Tipo di legame |
Distanza di legame |
Energia di legame (KJ/mol) |
|
Alcano (etano) |
C-H |
|
|
|
|
C=C H |
|
|
|
|
C |
|
|
|
benzene |
C-H |
|
|
Le lunghezze di legame dei C-H C-C e C-O confermano la teoria ma dicono anche qualcosa di più sconvolgendo strutture che credevamo definite in maniera chiara come il legame CO e CO2, di cui forse non sarebbe stato necessario interessarsi se non per la diversa risposta che danno all' IR e per interpretare la diversa forza di legame rispetto al CO carbonilico.
|
Composto |
Tipo di legame |
Distanza di legame( nm) |
Energia di legame(KJ/mol) |
|
Alcolico (es. metanolo) |
-C-O- |
|
|
|
Chetone, Aldeide (es. formica) |
C=O |
|
|
|
Biossido di carbonio CO2 |
O=C=O |
|
|
|
CO ossido di carbonio |
C |
|
(Atkins) 710 (Gaudiano) 670 ISEDI |
|
Carbonato |
C=O |
|
|
Per comprendere le distanze e le energie di legame riporto (leggermente rielaborato) parte del modulo 2 " Enciclopedia della chimica" ISEDI (modulo curato da Gatteschi e Scozzafava).
. Nelle molecole si formeranno le coppie di
legame n e quelle non condivise per completare le conurazioni a strati
completi intorno agli atomi. Nel
monossido di carbonio il numero complessivo di elettroni è dieci 4 per
il C e 6 per l'ossigeno. Scritto un
legame di tipo ![]() tra carbonio e ossigeno
tra carbonio e ossigeno
C-O
restano ancora otto elettroni. Se non ci fosse tecipazione ci vorrebbero ancora sei elettroni per completare l'ottetto del carbonio e sei per completare l'ottetto dell'ossigeno, in tutto dodici elettroni. La differenza tra questo numero e il numero di elettroni presenti è quattro, corrispondente a due coppie da condividere tra i due atomi. Evidentemente queste due nuove coppie di legame dovranno essere due coppie di legame n. Restano ancora due coppie che andranno assegnate una per ciascuno ai due atomi costituenti secondo la formula:
![]()
![]()
![]()
![]()
![]() C
O
C
O
Un altro metodo, grafico, per arrivare allo
stesso tipo di formula è quello di scrivere preliminarmente lo scheletro
di legami![]() , completando, per esempio, l'ottetto
dell'atomo più elettronegativo, assegnandogli tutte le coppie che gli
mancano come coppie non condivise, e assegnando le coppie avanzate
all'altro. In questo caso si arriva alla
formula:
, completando, per esempio, l'ottetto
dell'atomo più elettronegativo, assegnandogli tutte le coppie che gli
mancano come coppie non condivise, e assegnando le coppie avanzate
all'altro. In questo caso si arriva alla
formula:
![]()
![]()
![]()
![]() C O
C O
![]()
La regola dell'ottetto non viene, così, rispettata per il carbonio, che ha solo quattro elettroni intorno a sé. Se ora si trasformano delle coppie non condivise dell'ossigeno in coppie di legame non si altera il numero di elettroni intorno all'atomo di ossigeno, mentre si aumenta il numero di elettroni intorno all'atomo di carbonio. Si vede facilmente che spostando due coppie si arriva alla formula otteziale richiesta col triplo legame sopra vista.
In questo modo abbiamo interpretato la minore distanza di legame e la maggior energia di legame del legame CO. Resta il solo problema che l'ossigeno elettronegativo e con più elettroni dà al carbonio parte dei suoi. Si può allora supporre una struttura di risonanza fra le due formule con triplo legame e con legame semplice (giustificata anche da un momento dipolare spostato sull'ossigeno e la netta tendenza del carbonio a legarsi in difformità con l'azoto, ricordiamo la carbossiemoglobina ed il ferro-pentacarbonile) con però prevalenza della forma a legame triplo (giustificata dalla minor distanza di legame e dalla maggiore energia di legame, nonostante riportata con valori diversi da testi diversi)
Infine vale la pena di ricordare che in questo caso si poteva arrivare a scrivere la stessa formula osservando che CO è isoelettronico con N2 e quindi deve essere descritto dalla stessa formula.
A cosa ci serve questa determinazione della struttura reale? È solo uno sfizio teorico, tanto più tenendo presente che la teoria dei legami di valenza è stata superata da quella degli orbitali molecolari (che comunque completa ma non rinnega questi risultati, e raggiunge le stesse conclusioni, altrimenti ,come sapete, non ne parlerei per non generare confusioni)? Ovviamente oltre che all'interesse della chimica fisica di determinare l'esatta struttura, alla chimica analitica interessa la possibilità di prevedere ed interpretare i dati forniti da strumenti quali gli spettrofotometri UV ed IR
Per scrivere la formula di CO2 , c'è una difficoltà in più, perché è necessario sapere preliminarmente se i due atomi di ossigeno sono legati l'uno all'altro o ciascuno all'atomo di carbonio. Non esistono regole generali per risolvere dubbi di questo genere e il modo migliore per venire a capo di queste difficoltà è quello di ricorrere ai dati sperimentali. Legami ossigeno - ossigeno si trovano solo nei perossidi e superossidi; negli ossidi invece gli atomi di ossigeno sono legati esclusivamente ad atomi differenti. Nella molecola della CO2 sono presenti sedici elettroni; la formula corrispondente allo scheletro di legami a è:
![]()
![]() O
C O
O
C O
Il carbonio non raggiunge l'ottetto in questa formula; per raggiungerlo si devono trasformare due doppietti non condivisi dell'ossigeno in doppietti di legame. In questo caso, però, il processo non è univoco e può essere effettuato in tre differenti maniere: l'atomo di ossigeno di sinistra o quello di destra possono mettere in tecipazione due doppietti, oppure ambedue possono metterne in tecipazione uno ciascuno, dando luogo alle formule:
![]()
![]()
![]()
![]()
![]()
![]() | O
| O ![]() C O O C
C O O C![]() O| O = C = O
O| O = C = O
Tutte e tre le formule obbediscono alla regola dell'ottetto per tutti gli atomi che costituiscono la molecola: le prime due formule prese separatamente fanno prevedere l'esistenza di due diverse distanze carbonio - ossigeno; infatti uno dei due atomi di ossigeno è legato con un legame semplice, mentre l'altro è legato con un legame triplo, e si è già osservato come un legame multiplo sia più corto di un corrispondente legame semplice. Nella realtà, però, questo non si verifica, perché si osserva che le due distanze di legame carbonio-ossigeno sono uguali e i due atomi di ossigeno sono del tutto equivalenti. Questo potrebbe essere interpretato come prova della sostanziale scorrettezza delle prime due formule e si potrebbe essere indotti a considerare corretta solo la terza. Se però il legame fosse unicamente un legame doppio non vi sarebbe ragione della diversa distanza di legame rispetto al C=O carbonilico. Al che significa che le altre due formule, con il legame triplo e singolo in qualche misura intervengono nella struttura complessiva della anidride carbonica. Tutto ciò avrà una spiegazione nella teoria degli O.M. si potrebbe continuare questa analisi delle formule di struttura delle molecole ma la si lascia a testi specializzati. Qui basta l'aver evidenziato come spesso una struttura, specie in presenza di legami multipli non sia facilmente definibile senza ricorrere agli ibridi di risonanza. Vediamo come possiamo cercare di superare questa situazione.
Teoria degli orbitali molecolari (MOT)
Ognuna delle precedenti teorie ha portato diversi contributi alla comprensione del legame chimico, ma ciascuna presentava diversi problemi inspiegabili tanto che questi difetti hanno reso necessaria la teoria successiva, fino a giungere, in ultima analisi, alla teoria degli orbitali molecolari, con la quale comunque si riesce ad ottenere una conferma quasi completa, non perfetta anche se soddisfacente, dei risultati sperimentali. La teoria degli orbitali molecolari è comunque fondamentale per la spiegazione delle interazioni tra energia e materia allo stato molecolare e ci costringe ad una pur semplificata trattazione (lungi dall'essere completa) per spiegare i risultati della spettrofotometria molecolare. I risultati qui descritti saranno abbastanza facilmente comprensibili per le molecole più semplici, mentre per le molecole più complesse si invita (onde evitare trattazioni difficili che richiederebbero anche l'aiuto si strumenti matematici) ad estrapolare intuitivamente i risultati ottenuti.
Questa teoria elaborata da Mulliken (dopo il1930) , partendo dalle equazioni d'onda di Schroedinger per gli orbitali atomici, li unisce in una molecola come combinazione lineari degli stessi (cioè sommando o sottraendo le funzioni d'onda degli orbitali atomici) ottenendo orbitali molecolari , definiti, in analogia con gli orbitali atomici, zone dello spazio con una certa probabilità di trovare gli elettroni di legame. Se i due elettroni combinati insieme hanno concordanza di fase la loro possibilità di unirsi sarà maggiore (interferenza costruttiva) e formeranno un orbitale molecolare con minor livello energetico (orbitale legante); se invece le equazioni d'onda sono in discordanza di fase la possibilità di formare degli orbitali sarà inferiore(interferenza distruttiva) ed avremo pertanto un orbitale (detto antilegante, e contrassegnato da un asterisco) con maggiore energia rispetto agli orbitali atomici di partenza.
L'equazione di Schroedinger, risolta in termini di probabilità di trovare un elettrone in una certa direzione, in funzione della distanza dal nucleo, aveva portato alla conclusione che l'orbitale 1s dell'idrogeno, aveva un andamento come quello sotto riportato. Analogo l'andamento per un secondo atomo di idrogeno.

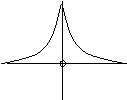
![]() H
H
La loro somma e la loro sottrazione portano alle seguenti conurazioni
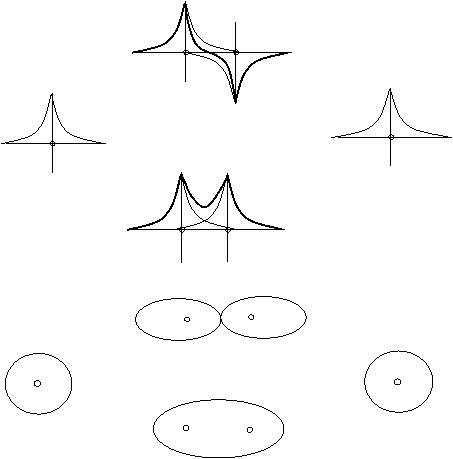
![]() -
-![]()
![]()
![]()
![]() +
+![]()

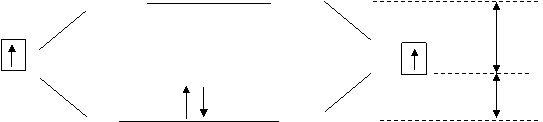 E
E ![]()
![]()
1 1

![]()
![]()
S S
In pratica le tre schematizzazioni dicono la stessa cosa in tre modi diversi. In alto abbiamo la somma e la sottrazione delle funzioni d'onda che portano alla formazione degli orbitali molecolari legante (maggiore probabilità di trovare gli elettroni nello spazio compreso fra i due nuclei della molecola di idrogeno) e antilegante (maggiore probabilità di trovare gli elettroni all'esterno dei due nuclei.
La cosa è rivista nella rappresentazione a orbitali a metà ina dove per altro si vede che in posizione centrale fra i due nuclei esiste addirittura un punto nodale (probabilità zero di trovare gli elettroni) nel caso di orbitale antilegante.
Nella terza rappresentazione , quella che poi viene indicata normalmente, e si userà anche in seguito, si ha anche la rappresentazione dei livelli energetici degli orbitali leganti ed antileganti.
Di norma il guadagno di energia che si ha, passando da una situazione
di orbitale atomico di atomo singolo ad una situazione di orbitale legante,![]() ,
è inferiore alla energia necessaria per passare dalla situazione di
orbitale atomico di atomo singolo ad una situazione di orbitale antilegante
,
è inferiore alla energia necessaria per passare dalla situazione di
orbitale atomico di atomo singolo ad una situazione di orbitale antilegante![]() .
La qual cosa porta alla conclusione che mentre è stabile ed esiste la
molecola di H2, non è stabile e non esiste l'eventuale
molecola He2 dove due elettroni darebbero origine all'orbitale
legante
.
La qual cosa porta alla conclusione che mentre è stabile ed esiste la
molecola di H2, non è stabile e non esiste l'eventuale
molecola He2 dove due elettroni darebbero origine all'orbitale
legante ![]() 1s
e due elettroni all'orbitale antilegante
1s
e due elettroni all'orbitale antilegante ![]() *1s
( il pedice 1s, significa che questi orbitali molecolari derivano dagli
orbitali atomici 1s, ma la stessa notazione non è usata da tutti gli
autori) con perdita di stabilità totale secondo la conurazione qui di
seguito riportata:
*1s
( il pedice 1s, significa che questi orbitali molecolari derivano dagli
orbitali atomici 1s, ma la stessa notazione non è usata da tutti gli
autori) con perdita di stabilità totale secondo la conurazione qui di
seguito riportata:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() E
E ![]() 1s
1s
![]()
![]()
![]()
![]()
![]() 1 1
1 1
![]()
![]()
![]()
![]()
![]() 1s
1s
![]()
S S
Per gli atomi del secondo periodo si ha una conurazione del tipo sotto riportata (per ossigeno e fluoro):
ơ * 2px
![]()
2py 2pz
![]()
![]() 2p 2p
2p 2p
2py π 2pz
2px
2s

![]()
![]() 2s 2s
2s 2s
2s
A seconda dell'elemento, e quindi del n° di
elettroni presenti nei vari orbitali atomici, riempiamo i vari orbitali molecolari. Per alcuni elementi
come l'azoto si ha inversione di stabilità fra gli orbitali ![]() 2p e
2p e ![]() 2p
pertanto non bisogna stupirsi se su altri testi ( es. Atkins . 313) troviamo
conurazioni energetiche molecolari differenti da quella qui sopra
presentata. Qui di seguito riportiamo la situazione completa, per il secondo
periodo, presentata da Atkins (. 314,
dove però ho cambiato la simbologia sulla indicazione dei nomi degli
orbitali molecolari, per adeguarmi a quella più comunemente utilizzata)
2p
pertanto non bisogna stupirsi se su altri testi ( es. Atkins . 313) troviamo
conurazioni energetiche molecolari differenti da quella qui sopra
presentata. Qui di seguito riportiamo la situazione completa, per il secondo
periodo, presentata da Atkins (. 314,
dove però ho cambiato la simbologia sulla indicazione dei nomi degli
orbitali molecolari, per adeguarmi a quella più comunemente utilizzata)
*2p
*2p
2p
2p
*2s
2s
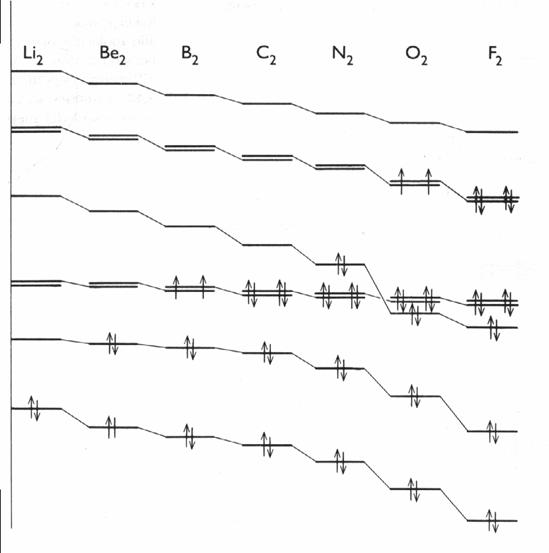
In questo modo si spiega il paramagnetismo
dell'ossigeno (a causa degli spin degli orbitali antileganti orientati
concordemente) e la grande forza del legame N![]() N.
N.
L'ordine di legame (in pratica la valenza) è data dalla differenza fra il n° di coppie elettroniche in orbitali leganti ed il n° di coppie elettroniche in orbitali antileganti.
Ovviamente con questo metodo si possono costruire anche le conurazioni di molecole eteronucleari (formate da atomi diversi Es. HF, vedi Atkins . 321, CO ecc.), ma su questa possibilità non ci soffermeremo oltre, anche perché si arriverebbe a situazioni complesse. Ci basti osservare che essendo diverso il numero degli elettroni nei due atomi che si combinano, gli elettroni di alcuni orbitali atomici (dell'elemento con più elettroni) non hanno con chi combinarsi e rimangono nella molecola come orbitali non leganti n (né leganti, né antileganti). E' il caso dovuto alla presenza di ossigeno azoto nelle molecole organiche. E' qui sotto schematizzata la situazione per il gruppo carbonilico CO, dove sull'ossigeno rimane una coppia di elettroni non leganti (in grigio gli elettroni che si sono combinati)
C O

Affrontiamo ora il problema della costruzione delle molecole pluriatomiche, dove utilizziamo i criteri già visti per la costruzione degli orbitali molecolari, tenendo presente che da n orbitali atomici si ottengono n orbitali molecolari, e che non si considerano solo le coppie degli atomi vicini, ma si considerano tutti gli atomi della molecola, senza ricorrere né al concetto di ibridazione né a quello di risonanza.
Ogni orbitale però non può mai ospitare più di due elettroni secondo il principio di Pauli (già visto per gli orbitali atomici. Il caso più classico è quello della molecola del benzene in cui i 6 orbitali atomici 2pz, perpendicolari al piano della molecola si combinano insieme per dare 6 orbitali molecolari, 3 orbitali leganti e tre orbitali antileganti. Ognuno di questi orbitali si estende per tutto l'anello ed è costituito dalla combinazione lineare (somma e sottrazione) in vari modi possibili delle equazioni d'onda dei 6 orbitali atomici 2pz. Si otterranno (vedi anche Amandola Terreni . 114-l15) orbitali leganti pieni, ed antileganti vuoti. Gli orbitali leganti e quelli antileganti hanno diversa energia a seconda del numero e della posizione delle equazioni d'onda sommate in concordanza o discordanza di fase.
Riporto ancora un diagramma dell'Atkins, dove le equazioni d'onda in fase sono disegnate con lo stesso colore e, a fianco i livelli energetici corrispondenti. Ovviamente l'orbitale molecolare più stabile è quello a cui corrisponde la somma di tutte equazioni d'onda in fase, mentre quello più instabile è quello a cui corrisponde un alternanza di orbitali molecolari in discordanza di fase.
 |
 |
Su
questo fenomeno si basa anche l'effetto Seebeck meccanismo alla base della
costruzione delle termocoppie per cui un aumento di temperatura ad un capo di
un conduttore porta ad un flusso di elettroni che parte dalla zona più
calda e diretta alla zona più fredda, flusso di entità diversa da
conduttore a conduttore.
Il carbonio forma due ossidi CO e CO 2
Per comprendere le distanze e le energie di legame riporto (leggermente rielaborato) parte del modulo " Enciclopedia della chimica" ISEDI (modulo curato da Gatteschi e Scozzafava).
. Nelle molecole si formeranno le coppie di
legame n e quelle non condivise per completare le conurazioni a strati
completi intorno agli atomi. Nel
monossido di carbonio il numero complessivo di elettroni è dieci 4 per
il C e 6 per l'ossigeno. Scritto un
legame di tipo ![]() tra carbonio e ossigeno
tra carbonio e ossigeno
C-O
restano ancora otto elettroni. Se non ci fosse tecipazione ci vorrebbero ancora sei elettroni per completare l'ottetto del carbonio e sei per completare l'ottetto dell'ossigeno, in tutto dodici elettroni. La differenza tra questo numero e il numero di elettroni presenti è quattro, corrispondente a due coppie da condividere tra i due atomi. Evidentemente queste due nuove coppie di legame dovranno essere due coppie di legame n. Restano ancora due coppie che andranno assegnate una per ciascuno ai due atomi costituenti secondo la formula:
![]()
![]()
![]()
![]()
![]() C
O
C
O
Un altro metodo, grafico, per arrivare allo
stesso tipo di formula è quello di scrivere preliminarmente lo scheletro
di legami![]() , completando, per esempio, l'ottetto
dell'atomo più elettronegativo, assegnandogli tutte le coppie che gli
mancano come coppie non condivise, e assegnando le coppie avanzate
all'altro. In questo caso si arriva alla
formula:
, completando, per esempio, l'ottetto
dell'atomo più elettronegativo, assegnandogli tutte le coppie che gli
mancano come coppie non condivise, e assegnando le coppie avanzate
all'altro. In questo caso si arriva alla
formula:
![]()
![]()
![]()
![]() C O
C O
![]()
La regola dell'ottetto non viene, così, rispettata per il carbonio, che ha solo quattro elettroni intorno a sé. Se ora si trasformano delle coppie non condivise dell'ossigeno in coppie di legame non si altera il numero di elettroni intorno all'atomo di ossigeno, mentre si aumenta il numero di elettroni intorno all'atomo di carbonio. Si vede facilmente che spostando due coppie si arriva alla formula otteziale richiesta col triplo legame sopra vista.
In questo modo abbiamo interpretato la minore distanza di legame e la maggior energia di legame del legame CO Resta il solo problema che l'ossigeno elettronegativo e con più elettroni dà al carbonio parte dei suoi. Si può allora supporre una struttura di risonanza fra le due formule con triplo legame e con legame semplice (giustificata anche da un momento dipolare spostato sull'ossigeno e la netta tendenza del carbonio a legarsi in difformità con l'azoto, ricordiamo la carbossiemoglobina ed il ferropentacarbonile) con però prevalenza della forma a legame triplo
A cosa ci serve questa determinazione della struttura reale? È solo uno sfizio teorico, tanto più tenendo presente che la teoria dei legami di valenza è stata superata da quella degli orbitali molecolari (che comunque completa ma non rinnega questi risultati, e raggiunge le stesse conclusioni, altrimenti ,come sapete, non ne parlerei per non generare confusioni).
Infine val la pena di ricordare che in questo caso si poteva arrivare a scrivere la stessa formula osservando che CO è isoelettronico con N2 e quindi deve essere descritto dalla stessa formula.
Per scrivere la formula di CO2 , c'è una difficoltà in più, perché è necessario sapere preliminarmente se i due atomi di ossigeno sono legati l'uno all'altro o ciascuno all'atomo di carbonio. Non esistono regole generali per risolvere dubbi di questo genere e il modo migliore per venire a capo di queste difficoltà è quello di ricorrere ai dati sperimentali. Legami ossigeno - ossigeno si trovano solo nei perossidi e superossidi; negli ossidi invece gli atomi di ossigeno sono legati esclusivamente ad atomi differenti. Nella molecola della CO2 sono presenti sedici elettroni; la formula corrispondente allo scheletro di legami a è:
![]()
![]() O
C O
O
C O
Il carbonio non raggiunge l'ottetto in questa formula; per raggiungerlo si devono trasformare due doppietti non condivisi dell'ossigeno in doppietti di legame. In questo caso, però, il processo non è univoco e può essere effettuato in tre differenti maniere: l'atomo di ossigeno di sinistra o quello di destra possono mettere in tecipazione due doppietti, oppure ambedue possono metterne in tecipazione uno ciascuno, dando luogo alle formule:
![]()
![]()
![]()
![]()
![]()
![]() | O
| O ![]() C O O C
C O O C![]() O| O = C = O
O| O = C = O
Tutte e tre le formule obbediscono alla regola dell'ottetto per tutti gli atomi che costituiscono la molecola: le prime due formule prese separatamente fanno prevedere l'esistenza di due diverse distanze carbonio - ossigeno; infatti uno dei due atomi di ossigeno è legato con un legame semplice, mentre l'altro è legato con un legame triplo, e si è già osservato come un legame multiplo sia più corto di un corrispondente legame semplice. Nella realtà, però, questo non si verifica, perché si osserva che le due distanze di legame carbonio-ossigeno sono uguali e i due atomi di ossigeno sono del tutto equivalenti. Questo potrebbe essere interpretato come prova della sostanziale scorrettezza delle prime due formule e si potrebbe essere indotti a considerare corretta solo la terza. Nel caso seguente si vedrà però, che c'è una debolezza intrinseca nelle formule come sono state descritte finora e verrà indicata la via per superare queste difficoltà.
Accanto alle specie neutre ora illustrate il carbonio può formare anche l'anione carbonato CO2-; il numero complessivo di elettroni in questa specie molecolare è ventiquattro e la formula con i soli legami a è del tipo:
lol
Anche questa volta la formula non rispetta la regola dell'ottetto per l'atomo di carbonio che ha solo sei elettroni. La coppia mancante può ven ' ir fornita da uno dei tre atomi di ossigeno, formando un legame doppio. Evidentemente tutti e tre gli atomi di ossigeno possono fornire il doppietto dando luogo alle tre formule diverse:
/O F0-l
1 o Oi, .
In queste tre formule i legami che uniscono l'atomo di carbonio ai tre atomi di ossigeno non sono equivalenti, perché si ha un legame doppio e due semplici. Anche in questo caso, quindi, si dovrebbe concludere che nello ione carbonato le due distanze di legame carbonio-ossigeno sono uguali e una terza è più corta. Le determinazioni strutturali hanno, però, mostrato al di là di ogni dubbio che le tre distanze di legame sono uguali. Si è, quindi, in presenza di una chiara insufficienza delle notazioni che sono state adottate per le formule sulla base del concetto di legame a coppia di elettroni e della regola dell'ottetto, in quanto previsioni che si fanno sulla base di questo modello sono smentite dal confronto con dati sperimentali. Le strade che si possono aprire a questo punto sono due: o si cambia completamente modello, oppure si cerca di introdurre delle
correzioni sul modello del legame a coppia di elettroni per permettergli di essere più aderente ai dati sperimentali. La seconda è la strada che verrà seguita, principalmente perché il modello è molto semplice e con poche correzioni, che non ne alterano sostanzialmente i pregi, può essere usato per nazionalizzare un più largo numero di dati sperimentali.
Riprendendo in considerazione le formule dello ione carbonato si può dire che il legame doppio si può trovare con uguale probabilità su tutti e tre gli atomi di ossigeno: ciascuna delle tre rappresentazioni fornite è di per se stessa insufficiente perché non tien conto dell'indistinguibilità dei tre atomi di ossigeno, ma se si considerano tutte e tre insieme si ha un'immagine più esatta della distribuzione della densità elettronica nello ione. In altri termini, si possono interpretare le tre formule'affermando che un legame carbonio-ossigeno è per due terzi quello descritto da un legame semplice e per un terzo quello descritto da un legame doppio. fE evidente, quindi, che a questo punto si è dovuto ammettere che la densità elettronica nel legame tra due atomi possa essere diversa da quella dovuta a un numero intero di coppie di legame. In altri termini si è dovuto constatare che oltre a distribuzioni stabili di densità elettronica corrispondenti a due, quatt ro, sei ecc. elettroni se ne possono avere anche con un numero qualunque di elettroni.
La rappresentazione della formula molecolare di un composto per mezzo di più formule viene detta, risonanza. Le formule che si usano per la rappresentazione sono detteformule risonanti e di solito si scrivono separate le une dalle altre da frecce a doppia punta (@), frecce che non devono essere in alcun modo confuse con l'analoga notazione che si usa per gli equilibri chimici: le formule risonanti non corrispondono a nessuna specie reale, ma sono ciascuna una rappresentazione approssimata della molecola vera. Esse sono solo delle formule limite che delimitano la vera distribuzione della densità elettronica. La miglior rappresentazione della molecola reale si ha prendendo in considerazione tutte le formule risonanti che si possono scrivere in base alle regole fin qui accennate.
Nonostante che la giustificazione di questo modello, di per sè piuttosto astruso, sia ritrovabile nella meccanica quantistica, è pos-
sibile cercare di avvicinarsi al vero significato delle formule risonanti con un paragone, dovuto a Ingold, che fu uno dei primi volgarizzatori del modello. La descrizione appena data della struttura molecolare si può paragonare alla descrizione di un viaggiatore medievale che, avendo visitato l'Africa, e avendo visto un rinoceronte, voglia far capire ai suoi connazionali al ritorno quale sia l'aspetto di questo strano animale. Può dire, per esempio che l'animale visto è un qualche cosa di intermedio tra un drago, di cui ha la stessa pelle ruvida e spessa, e un liocorno, di cui ha lo stesso corno in mezzo alla fronte. Per descrivere, cioè, l'animale realmente esistente, ma sconosciuto ai suoi ascoltatori, cerca di confrontarne l'aspetto con quello di animali mitici, che nella realtà non esistono, ma che sono capaci di suscitare concetti molto precisi nella mente dei suoi ascoltatori. In questo caso il rinoceronte è la molecola reale, che si descrive attraverso una serie di liocorni e di draghi, che sono le formule limite.
Ritornando, infine, allo ione carbonato si
può vedere quanto la descrizione del legame come legame intermedio tra semplice e doppio sia effettivamente rispondente alla realtà confrontando le distanze di legame carbonio ossigeno con quelle rilevate in composti in cui carbonio e ossigeno sono sicuramente legati con un legame semplice o con un legame doppio. Nella tab. 2.4 sono riportati alcuni di tali esempi significativi. Dall'esame della tabella si vede che effettivamente la distanza C-O nello'ione carbonato è intermedia tra quella corrispondente a un legame semplice e quella di un legame doppio. Se si provasse a calcolare la distanza di legame nello ione carbonato, come due terzi della distanza di un legame semplice più un terzo di quella di un legame doppio si troverebbe 1,35 A, che è quasi in accordo con la distanza osservata sperimentalmente di 1,31 A: qualitativamente, quindi, il modello della risonanza permette di fare delle previsioni corrette sulla struttura delle molecole.
Se si confrontano i dati della tab. 2.4 con le distanze di legame carbonio-ossigeno di C02 e CO, che sono 1,16 e 1,12 A rispettivamente, si vede che le descrizioni fornite dei legami sono in buon accordo con le distanze di legame doppio e triplo rispettivamente.
Ovviamente con gli esempi citati non si
sono esauriti tutti i composti del carbonio con l'ossigeno: il carbonio ha, infatti, una tendenza, quasi unica tra tutti gli elementi del Sistema periodico degli elementi, a unirsi in catene o in anelli, formando forti legami carbonio-carbonio. Questa capacità peculiare dà luogo a un gran numero di composti che si prestano a uno studio sistematico, perché si può passare da un termine di una
Tab. 2.4 - Alcune distanze di legame car-
bonio-ossigeno.
Composto Tipo di Distanza di
legame legame (A)
Alcool metilico C-O 1,42
Aldeide formica C=O 1,21
Biossido di carbonio, C=O 1,16
Ossido di carbonio C=- 0 1,13
Carbonato C=O* i 31
I I
* L'ordine di legame è in questo caso 413.
serie a un altro aggiungendo un atomo di carbonio, variando, quindi, relativamente poco le proprietà delle sostanze. Questi fatti sono alla base della divisione in chimica organica (12), che è la chimica dei composti del carbonio, e chimica inorganica (9), che è la chimica di tutti gli altri composti di tutti gli altri elementi del Sistema periodico.
Per concludere l'esame dei composti con l'ossigeno si prenderanno in esame quelli di tale elemento con l'azoto. Tra gli ossidi i più importanti sono: N20, NO, N02; esi-
stono anche ioni NO+, NO-, NO- ecc.
3
Poiché l'ossigeno ha un numero pari di elettroni e l'azoto ne ha un numero dispari (5), le specie neutre in cui è contenuto un solo atomo di azoto devono avere un numero dispari di elettroni. Le molecole come NO e N02 sono dette talvolta molecole dispari, proprio perché hanno un numero dispari di elettroni. Evidentemente non è possibile scrivere per queste molecole delle formule in cui tutti gli atomi abbiano una conurazione otteziale.
L'ossido d'azoto, NO, ha in tutto undici elettroni: scrivendo prima di tutto la formula con un legame a si ha:
IN-01
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta