| chimica |
|
TENSIONE DI VAPORE DELLE SOLUZIONI: LA LEGGE DI RAOULT.
Si consideri un recipiente chiuso contenente una soluzione di due liquidi L1 ed L2 completamente miscibili tra loro. La velocità di evaporazione ve di L1 dalla soluzione e la velocità di condensazione vc di L1 dalla fase di vapore possono essere ricavate come è stato descritto nel modulo precedente per un liquido puro, tenendo però conto del fatto che sia nella fase liquida che in quella di vapore sono presenti oltre alle molecole n1 di L1 anche quelle n2 di L2. Pertanto nelle espressioni delle velocità occorre considerare le frazioni molari del liquido L1 sia in fase liquida sia in fase di vapore.
Posto
![]()
sarà:

Considerando che la fase vapore si comporti come un gas ideale ed applicando l'equazione di stato in condizioni di equilibrio, si ottiene:
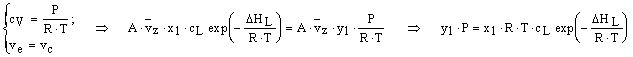
dove P è la tensione di vapore della soluzione registrata dal manometro.
Ricordando che:
![]()
dove p1° è la tensione di vapore di L1 allo stato puro, si ha la seguente relazione:
![]()
nota come legge di Raoult e secondo cui la pressione di vapore di un componente di una miscela di composti molecolari è uguale al prodotto della sua pressione di vapore, quando è puro ed alla stessa temperatura, per la sua frazione molare.
Qualunque soluzione la cui pressione di vapore dipenda dalla concentrazione secondo la relazione espressa dalla legge di Raoult, è detta soluzione ideale. In tal modo una definizione di soluzione ideale è anche quella che essa obbedisca alla legge di Raoult.
|
|
Considerando che in soluzione x1<1, la tensione di vapore di un liquido in soluzione è sempre minore che allo stato puro. Ciò era da aspettarselo, dal momento che abbiamo considerato soluzioni ideali e dunque l'evaporazione di un componente non viene influenzata dalle interazioni con gli altri.
Il comportamento ideale di tale miscela è messo in evidenza dal grafico di lato in cui vengono riportate le tensioni di vapore dei due componenti e della soluzione in funzione della concentrazione.
In tale grafico si può vedere come la variazione delle tensioni parziali di vapore al variare della concentrazione sia lineare, in conformità con la legge di Raoult.
Si esaminino le conseguenze analitiche della legge di Raoult.
Detti L1 il solvente ed L2 il soluto, dato che la frazione molare del soluto è data da x2=1-x1, si ha:
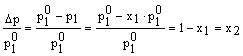
e quindi l'abbassamento relativo della tensione di vapore di una soluzione è numericamente uguale alla frazione molare del soluto.
La tensione di vapore P della soluzione potrà facilmente ottenersi mediante l'applicazione della legge di Dalton:
![]()
e quindi dalla relazione
![]()
si deduce facilmente che la composizione di una miscela liquida è necessariamente diversa dalla composizione del vapore in equilibrio con la soluzione se le pressioni di vapore dei componenti sono diverse.
Essendo

e posto
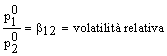
dalla definizione di frazione molare si ha:
![]()
e quindi, se L1 è più volatile di L2 (b >1), si ottiene:
|
|
![]()
ossia nella fase gassosa in equilibrio con una miscela liquida si ha un arricchimento nel componente più volatile (quello con tensione di vapore più alta).
In ura di lato sono riportate le frazioni molari y1, nella fase di vapore, del componente più volatile in funzione della frazione molare x1 dello stesso componente nella soluzione al crescere della volatilità relativa b. Tali valori sono ottenuti dall'equazione:
![]()
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta