| chimica |
|
|||||
|
Nelle combustioni il processo a regime può essere considerato adiabatico , le x calorie sviluppate nella combustione non vengono scambiate con l'ambiente ma rimangono nel sistema aumentandone la temperatura :
![]() = - x negativo perché l'energia viene
persa dal sistema
= - x negativo perché l'energia viene
persa dal sistema
questa energia non viene ceduta all'ambiente ma è acquistata dal sistema stesso che varia la sua temperatura e vale l'equazione :
![]() +
+ ![]() c
c![]()
![]() dT
dT
Schematicamente :
a T = 298 K C![]() H
H![]() + y O
+ y O![]() (eccesso)
(eccesso) ![]() n CO
n CO![]() +
(n+1) H
+
(n+1) H![]() O
O
![]()
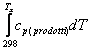
![]()
a T = T![]() n CO
n CO![]() + (n+1)H
+ (n+1)H![]() O
O
Si parla di sistemi confinati quando si ha un effetto termico
tale da non avere una cinetica di smaltimento , il calore sviluppato è
acquistato dai prodotti di reazione che si portano alla temperatura T![]() .
Impropriamente si può dire che il sistema si comporta come se fosse
adiabatico.
.
Impropriamente si può dire che il sistema si comporta come se fosse
adiabatico.
Bisogna però tenere presente i seguenti limiti e le seguenti correzioni :
i calori specifici a pressione costante variano con la temperatura
l'eccesso di comburente ( O![]() o N
o N![]() ) che non ha reagito va considerato come presente nel sistema dei prodotti
) che non ha reagito va considerato come presente nel sistema dei prodotti
la reazione non è completa perché è
sfavorita dall'aumento della temperatura essendo la variazione entalpica
negativa , la mancanza di combustione completa implica la modifica del ![]() che è più piccolo e
conseguentemente è minore anche il salto termico
che è più piccolo e
conseguentemente è minore anche il salto termico
eventuale dissociazione delle molecole che è accomnata da un valore di energia di legame che a sua volta determina un minore salto termico
la reazione risulta non confinata cioè il calore viene comunque dissipato all'esterno.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta