| chimica |
|



Fase sperimentale
Materiale occorrente: Tabella:
|
HCl 0.1 N |
NaOH 0.08 N |
H2O |
PH sperimentale |
PH teorico |
|
40 ml |
0 ml |
50 ml |
|
|
|
40 ml |
5 ml |
50 ml |
|
|
|
40 ml |
10 ml |
50 ml |
|
|
|
40 ml |
20 ml |
50 ml |
|
|
|
40 ml |
35 ml |
50 ml |
|
|
|
40 ml |
39 ml |
50 ml |
|
|
|
40 ml |
40 ml |
50 ml |
|
|
|
40 ml |
50 ml |
50 ml |
|
|
|
40 ml |
50.6 ml |
50 ml |
|
|
soluzione tampone,
pH-metro,
agitatore,
2 burette,
2 becher,
acido cloridrico HCl,
soda NaOH,
magnete,
elettrodi,
sostegno elettrodi,
fenolfataleina,
spruzzetta.
Formula chimica:
![]() HCl + NaOH NaCl + H2O
HCl + NaOH NaCl + H2O
Indice N =
normalità, V = volume, Vtot.
= Volume totalre, log =
logaritmo.
Formula generale di pH:
n° moli H+ = N * V,
n° moli OH = N * V,
[H+] = n° moli H - n°moli OH
,
![]() Vtot.
Vtot.
pH = -log [H+] .
Procedimento:
Si prende un pH-metro e si calibra con due soluzioni tamponi di cui una a pH 4 mentre l'altro a pH 7. Per calibrare un pH-metro è necessario prendere un agitatore al di sopra del quale viene messo un becher all'interno del quale è stata versata una soluzione tampone a pH 7. All'interno di questa soluzione viene messo un magnete che non appena verrà acceso l'agitatore inizierà ad agitarsi., così da rendere la soluzione omogenea. Dopo di che vengono immersi due elettrodi all'interno della soluzione fino a quando sul display del pH-metro non e il valore del pH della soluzione tampone (in questo caso 7). Lo stesso identico procedimento viene fatto con una soluzione di ph 4.
Contemporaneamente alla calibrazione del pH-metro, si prendono due burette e si riempiono di acido cloridrico e soda. Si prelevano 40 ml di acido cloridrico, che verrà versato su un becher, e a questa si aggiunge qualche goccia di fenolftaleina che ha il compito di indicare il passaggio della soluzione da acido a base, o viceversa. Nel caso i cui la situazione è acida,l'indicatore sarà incolore mentre nel caso in cui la soluzione è basica l'indicatore assume un colore roseo. In particolare rimane incolore fino a pH 8.2 , assume un colore intermedio tra 8.2 e 10 e infine asssume una colorazione rosea al di sopra di pH 10.
Ai 40 ml di acido cloridrico si aggiungono 50 ml di acqua e cosi la soluzione si è portata a pH 1.44 con un errore percentuale rispetto a quello teorico del 6.67 %.
A questa soluzione si aggiunge pian piano la soda fino a quando la fenlftaleina non reagirà riuscendo a indicare il passaggio della soluzione da acido forte a base forte, cioè il punto di viraggio. Il punto di viraggio avviene quando sono stati versati 50 ml di soda.
Fase sperimentale
Materiale occorrente:
2 burette,
2 becher,
acido cloridrico HCl,
soda NaOH,
fenolfataleina.
Formula chimica:
![]() HCl + NaOH NaCl + H2O
HCl + NaOH NaCl + H2O
Indice N =
normalità, V = volume.
Formula generale di pH:
N1 * V1 = N2 * V2
N2 = N1 * V1
![]() V2
V2
Procedimento:
Si prendono due burette e si riempiono di acido cloridrico e soda. Si prelevano 25 ml di acido cloridrico 0.1 N, che verrà versato su un becher, e a questa si aggiunge qualche goccia di fenolftaleina che ha il compito di indicare il passaggio della soluzione da acido a base, o viceversa.
A questa soluzione si aggiunge pian piano la soda fino a quando la fenlftaleina non reagirà riuscendo a indicare il passaggio della soluzione da acido forte a base forte, cioè il punto di viraggio. Il punto di viraggio avviene quando sono stati versati 28.3 ml di soda. Il nostro obiettivo è calcolare la normalità della soda da noi incognita. Utilizzando la formula precedentemente indicata
ricaviamo che la sua normalità è pari a 0.08.
Fase di problematizzazione
Durante questa esperienza di laboratorio, abbiamo effettuato due esperienze che ci hanno consentito di determinare la normalità di una delle due soluzioni, e realizzare la titolazione di un acido forte e di una base forte.
La prima definizione di acido e di base fu fatto da Arrhenius.
Secondo Arrhenius, gli acidi sono sostanze che in soluzione acquosa si ionizzano per dare ioni H+ e anioni, cioè elementi con carica negativa.
Mentre, una base secondo Arrhenius, è una sostanza che in soluzione acquosa si ionizza per dare ioni OH- e cationi, cioè elementi con carica positiva.
La teoria di Arrhenius, però presenta parecchi limiti che però furono risolti da Brönsted e da Lowry.
Questa nuova teoria, afferma che un acido è una sostanza capace di donare ioni H+, mentre le basi sono quelle sostanze capaci di accettare ioni H+.
Nella teoria di Brönsted e Lowry il concetto di acido e di base è associato al protone che viene trasferito da una specie chimica ad un'altra, mentre Lewis definì base una molecola che può dare una coppia di elettroni(lone pairs) ad un altro atomo per formare un nuovo legame.
Invece definì acido, una molecola che può accettare una coppia di elettroni da un altro atomo per formare un nuovo legame.
Apparte queste diverse teorie, bisogna distinguere gli acidi forti da quelli deboli, e le basi deboli da quelle forti.
Per acido forte, si intende quell'acido che in acqua diventa completamente ionizzato e cede completamente idrogeno (H+),mentre per acido debole si intende quell'acido che in acqua non si ionizza completamente e quindi non cede del tutto gli ioni idrogeno.
Per base forte, si intende quella base che in acqua cede completamente ioni OH-, mentre per base debole, si intende quella base che in acqua non cede completamente ioni OH-.
Come abbiamo detto in precedenza, lo scopo della nostra esperienza è realizzare la titolazione di un acido forte e di una base forte. Visto che abbiamo già fatto la differenza tra acidi e basi, è necessario definire la titolazione.
 Per titolazione, si intende un metodo chimico usato per determinare la concentrazione
di un acido o di una base aggiungendo un reattivo di natura opposta, di
concentrazione nota.
Per titolazione, si intende un metodo chimico usato per determinare la concentrazione
di un acido o di una base aggiungendo un reattivo di natura opposta, di
concentrazione nota.
In genere, la soluzione reattiva viene aggiunta goccia a goccia utilizzando una buretta, in modo che al termine della reazione sia immediato misurare il volume di reattivo aggiunto.
Le titolazioni si usano spesso per stabilire la concentrazione di soluzioni basiche- acide; in tal caso si misura il volume della soluzione reattiva necessaria per portare a completamento la reazione di neutralizzazione.
In una titolazione è importante rilevare il momento in cui la reazione giunge al termine, cioè quando si raggiunge il punto finale, detto anche punto di equivalenza. Una o due gocce di indicatore sono usualmente aggiunte per conoscere quando si arriva al punto di equivalenza.
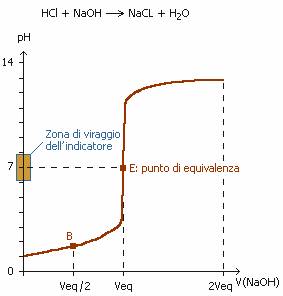
Quello che è stato detto sulla titolazione, si può rappresentare in una curva detta curva di titolazione.
Curva di titolazione
La curva di titolazione qui accanto indica, la variazione del pH in una soluzione di acido forte (acido cloridrico, HCl) dopo aggiunta progressiva di una base forte (idrossido di sodio, NaOH). Il punto di equivalenza E corrisponde al volume di base forte aggiunto in modo.. Se si indica il valore di pH corrispondente al volume di equivalenza e vi si aggiunge o toglie una unità, si ottiene un intervallo di pH che esprime la zona di viraggio dell'indicatore che dovrà essere utilizzato per individuare correttamente il punto di equivalenza.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta