| chimica |
|
Verifica della Legge di Boyle
Studiare la relazione che intercorre tra pressione e volume di un gas, costruire i diagrammi isotermi,con verifica della legge di Boyle.
Nel 1662 Boyle dimostrò che mantenendo costante la temperatura il volume di una data massa di gas è inversamente proporzionale alla pressione esercitata su di esso, il prodotto dei valori della pressione e del volume è una costante. In base a questa legge, ogni variazione della pressione provoca una variazione del volume, e viceversa.
p ∙ v = k
Siringa con scala graduata del volume di 60ml con sensibilità di "1 ml ", fissata su un supporto di ferro, con tappo di plastica da porre all'apice inferiore, per non farne fuoriuscire il gas, dieci piastre di vario peso.
 Si fissa l'ago alla siringa e si riempie con
il gas fino a 60ml, si chiude infilando l'ago delicatamente dentro un tappo di
gomma e si fissa la siringa in una posizione verticale all'apposito sostegno
con l'ago rivolto verso il basso. L'apice inferiore dello stantuffo indica il
valore di partenza del volume del gas contenuta nella siringa, il quale rappresenta il volume del gas alla
pressione atmosferica. All'estremità superiore dallo stantuffo della
siringa si pone il piattello con l'asta facendolo passare attraverso l'anello
fissato al sostegno. Lo stantuffo per effetto della forza applicata scende fino al raggiungimento della posizione
di equilibrio, l'indice posto sul lato della siringa indica il valore del
volume (V1) al nuovo equilibrio. Si procede ad altre misurazioni applicando di
volta in volta una piastra in più, usando lo stesso metodo ritogliendo
uno ad uno i piattelli (V2). Si riportano così tutti i valori nella
tabella. Con i quali si costruisce un grafico riportando in ordinate il volume
della siringa ed in ascissa la corrispondente pressione esercitata.
Si fissa l'ago alla siringa e si riempie con
il gas fino a 60ml, si chiude infilando l'ago delicatamente dentro un tappo di
gomma e si fissa la siringa in una posizione verticale all'apposito sostegno
con l'ago rivolto verso il basso. L'apice inferiore dello stantuffo indica il
valore di partenza del volume del gas contenuta nella siringa, il quale rappresenta il volume del gas alla
pressione atmosferica. All'estremità superiore dallo stantuffo della
siringa si pone il piattello con l'asta facendolo passare attraverso l'anello
fissato al sostegno. Lo stantuffo per effetto della forza applicata scende fino al raggiungimento della posizione
di equilibrio, l'indice posto sul lato della siringa indica il valore del
volume (V1) al nuovo equilibrio. Si procede ad altre misurazioni applicando di
volta in volta una piastra in più, usando lo stesso metodo ritogliendo
uno ad uno i piattelli (V2). Si riportano così tutti i valori nella
tabella. Con i quali si costruisce un grafico riportando in ordinate il volume
della siringa ed in ascissa la corrispondente pressione esercitata.
Al termine dell'esperienza si può completare la tabella dei dati riportando accanto a ciascun volume il valore della pressione corrispondente ricavandola dalla formula:
P = Pa + mp =
1.033∙π∙r²
Pa = 1 atm;
mp = la massa in Kg dei pesi aggiunti;
1.033∙Π∙r² è il fattore di conversione da atm a Kg/cm² (r = 1,5).
Avendo a disposizione tutti i dati si possono costruire i diagrammi isotermi.
|
|
ossigeno |
argon |
azoto |
||||
|
mp |
P |
V1 |
V2 |
V1 |
V2 |
V1 |
V2 |
|
0kg |
1atm |
60ml |
57ml |
60ml |
56ml |
60ml |
57ml |
|
0.706kg |
1.09atm |
55ml |
50ml |
56ml |
50ml |
56ml |
50ml |
|
1.608kg |
1.22atm |
49ml |
44ml |
49ml |
44ml |
48ml |
44ml |
|
2.517kg |
1.34atm |
43ml |
39ml |
43ml |
39ml |
43ml |
39ml |
|
3.423kg |
1.47atm |
39ml |
35ml |
39ml |
35ml |
39ml |
35ml |
|
4.332kg |
1.59atm |
35ml |
32ml |
35ml |
32ml |
35ml |
32ml |
|
5.244kg |
1.72atm |
32ml |
29ml |
32ml |
29ml |
32ml |
29ml |
|
6.160kg |
1.84atm |
29ml |
27ml |
29ml |
28ml |
29ml |
27ml |
|
7.078kg |
1.96atm |
27ml |
25ml |
27ml |
25ml |
27ml |
25ml |
|
7.996kg |
2.09atm |
25ml |
23ml |
25ml |
23ml |
25ml |
23ml |
|
8.915kg |
2.22atm |
24ml |
22ml |
23ml |
22ml |
23ml |
22ml |
|
9.839kg |
2.35atm |
22ml |
|
22ml |
|
22ml |
|
V1. volume dopo l'aggiunta del piattello V2. volume dopo aver tolto il piattello
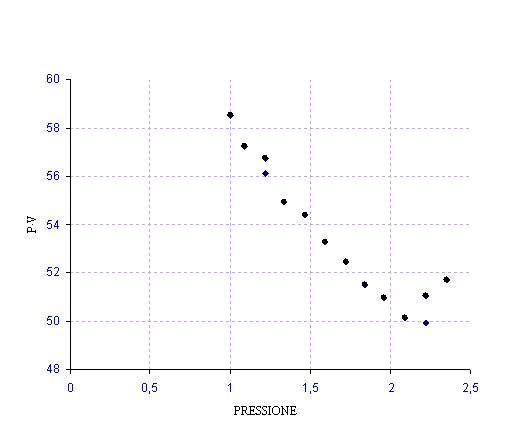
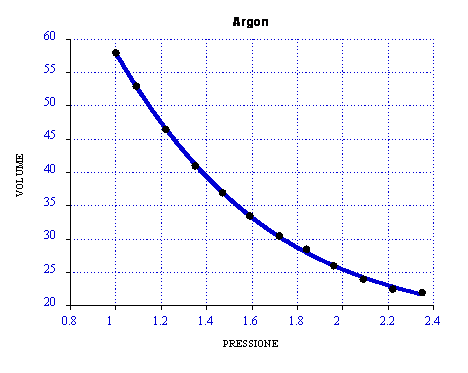
Osservando il grafico si nota come si verifica esattamente la legge di Boyle, nonostante l'esperimento non sia stato effettuato in condizioni ideali. Una della cause che ci fa capire la mancanza dell'idealità è l'attrito tra pistone e pareti, che si nota osservando i dati. In effetti i dati di diminuzione di peso (piattelli) non risultano uguali a quelli corrispondenti all'aggiunta dei piattelli. L'effetto dell'attrito rallenta il pistone.
|
P |
V |
|
1atm |
58.5ml |
|
1.09atm |
52.5ml |
|
1.22atm |
46.5ml |
|
1.34atm |
41ml |
|
1.47atm |
37ml |
|
1.59atm |
33.5ml |
|
1.72atm |
30.5ml |
|
1.84atm |
28ml |
|
1.96atm |
26ml |
|
2.09atm |
24ml |
|
2.22atm |
23ml |
|
2.35atm |
22ml |
![]()
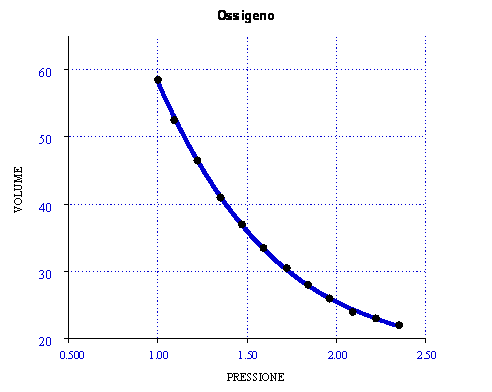 Diagramma V(P)
Diagramma V(P)
|
P |
PV |
|
1atm |
|
|
1.09atm |
|
|
1.22atm |
|
|
1.34atm |
|
|
1.47atm |
|
|
1.59atm |
|
|
1.72atm |
|
|
1.84atm |
|
|
1.96atm |
|
|
2.09atm |
|
|
2.22atm |
|
|
2.35atm |
|
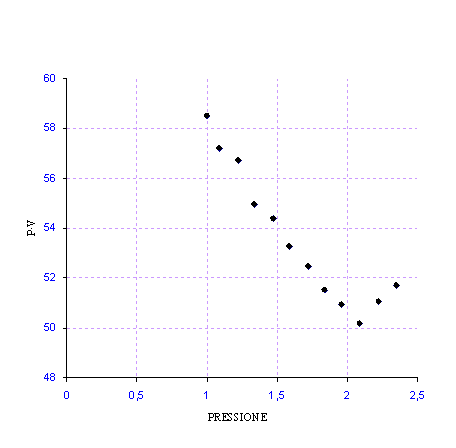
Diagramma PV(P)
![]()
Diagramma V(P)
|
P |
V |
|
1atm |
58.5ml |
|
1.09atm |
53ml |
|
1.22atm |
46ml |
|
1.34atm |
41ml |
|
1.47atm |
37ml |
|
1.59atm |
33.5ml |
|
1.72atm |
30.5ml |
|
1.84atm |
28ml |
|
1.96atm |
26ml |
|
2.09atm |
24ml |
|
2.22atm |
22.5ml |
|
2.35atm |
22ml |

Diagramma PV(P)
|
P |
PV |
|
1atm |
|
|
1.09atm |
|
|
1.22atm |
|
|
1.34atm |
|
|
1.47atm |
|
|
1.59atm |
|
|
1.72atm |
|
|
1.84atm |
|
|
1.96atm |
|
|
2.09atm |
|
|
2.22atm |
|
|
2.35atm |
|
Diagramma V(P)
|
P |
V |
|
1atm |
58ml |
|
1.09atm |
53ml |
|
1.22atm |
46ml |
|
1.34atm |
41ml |
|
1.47atm |
37ml |
|
1.59atm |
33.5ml |
|
1.72atm |
30.5ml |
|
1.84atm |
28ml |
|
1.96atm |
26ml |
|
2.09atm |
24ml |
|
2.22atm |
22.5ml |
|
2.35atm |
22ml |
 Diagramma PV(P)
Diagramma PV(P)
|
P |
PV |
|
1atm |
|
|
1.09atm |
|
|
1.22atm |
|
|
1.34atm |
|
|
1.47atm |
|
|
1.59atm |
|
|
1.72atm |
|
|
1.84atm |
|
|
1.96atm |
|
|
2.09atm |
|
|
2.22atm |
|
|
2.35atm |
|
Verifica della Legge di Graham
Verificare la legge di graham, attraverso la misura della velocità di diffusione dei gas (SF6; Ar; O2: N2; He; CH4; CO2) attraverso un foro sottile.
La velocità con cui un gas fuoriesce da un foro di piccole dimensioni è inversamente proporzionale alla radice quadrata del suo peso molecolare. Essendo la velocità inversamente proporzionale al tempo impiegato dal gas per uscire, la legge di Graham può essere data, in forma equivalente, affermando che il tempo impiegato da un gas per diffondere attraverso un foro di piccole dimensioni è direttamente proporzionale alla radice quadrata del suo peso molecolare.
![]()
![]() t = k
M
t = k
M
![]() Cronometro siringa con scala graduata, un
tappo autosigillante che è posizionato all'apposito sostegno viene
collegato ad una pompa ad acqua per creare il vuoto, la quale funziona per
effetto della depressione che si crea in corrispondenza di una strozzatura,
quando un liquido è costretto a scorrere in un condotto di sezione
variabile (in base al teorema di Bernoulli).
Cronometro siringa con scala graduata, un
tappo autosigillante che è posizionato all'apposito sostegno viene
collegato ad una pompa ad acqua per creare il vuoto, la quale funziona per
effetto della depressione che si crea in corrispondenza di una strozzatura,
quando un liquido è costretto a scorrere in un condotto di sezione
variabile (in base al teorema di Bernoulli).
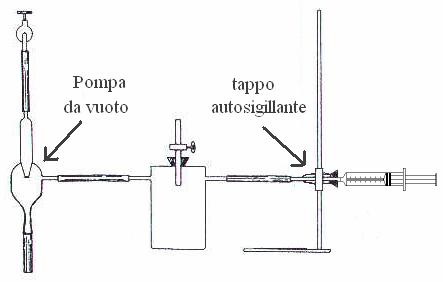 procedimento
procedimentoSi riempie la siringa con il gas a disposizione e si introduce nel tappo autosigillante il pistone inizierà così a muoversi e si misurerà il tempo che occorre al pistone di percorrere la parte della siringa scelta, la quale deve essere effettuata scartando i primi 10 ml e gli ultimi 10ml perché l'andamento dovrà essere costante.
|
Gas |
T1(°C) |
T2(°C) |
T(°C) |
MM |
√MM |
|
CHClF2 |
|
|
|
|
|
|
SF6 |
|
|
|
|
|
|
Ar |
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
N2 |
|
|
|
|
|
|
He |
|
|
|
|
|
|
CH4 |
|
|
|
|
|
|
CO2 |
|
|
|
|
|
T la media dei due tempi registrati nell'esperienza
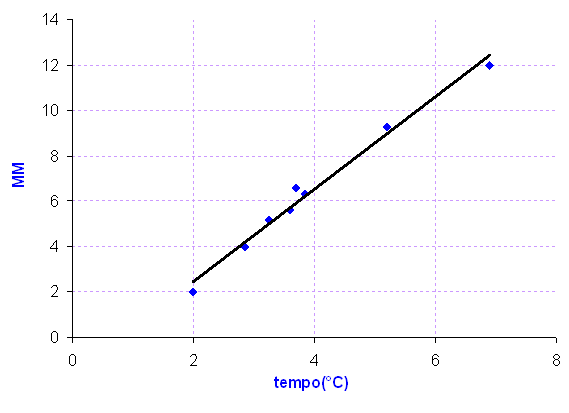 diagrammi
diagrammi![]()
Osservando il grafico è evidente come il tempo che impiega a diffondere il gas è proporzionale alla radice della massa molecolare, si nota anche che la retta non passa per l'origine. Questo avviene per effetto dell'attrito che esercita il pistone sulle pareti della siringa non permettendo un facile scorrimento ed ottenendo un tempo maggiore di quello ideale.
|
Determinazione del peso molecolare di una sostanza volatile |
Determinare il peso molecolare di sostanze che alla temperatura di ebollizione dell'acqua vaporizzano facilmente con un metodo simile a quello proposto da Mayer nel 1878.
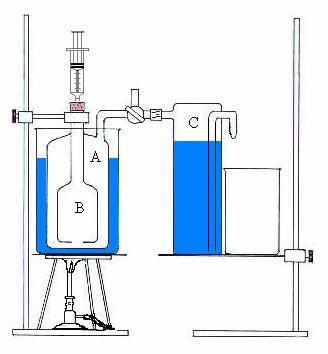 Siringa graduata con tappo di gomma, bilancia,
ed una apparecchiatura(.) composta da un recipiente cilindrico(A) che
contiene al suo interno un secondo recipiente cilindrico(B) che comunica con
l'esterno tramite un lungo collo chiuso all'estremità con un tappo
autosigillante, i due recipienti comunicano tra loro tramite un foro alla base
del recipiente B. Il recipiente A è immerso nell'acqua ed è collegato ad un rubinetto a tre vie il quale
tramite un tubo è collegato ad un altro recipiente(C), questo ha un tubo
all'interno che pesca l'acqua in fondo e termina all'esterno con un becco
rivolto verso il basso dove è posizionato il becher.
Siringa graduata con tappo di gomma, bilancia,
ed una apparecchiatura(.) composta da un recipiente cilindrico(A) che
contiene al suo interno un secondo recipiente cilindrico(B) che comunica con
l'esterno tramite un lungo collo chiuso all'estremità con un tappo
autosigillante, i due recipienti comunicano tra loro tramite un foro alla base
del recipiente B. Il recipiente A è immerso nell'acqua ed è collegato ad un rubinetto a tre vie il quale
tramite un tubo è collegato ad un altro recipiente(C), questo ha un tubo
all'interno che pesca l'acqua in fondo e termina all'esterno con un becco
rivolto verso il basso dove è posizionato il becher.
Posizionare il rubinetto a tre vie in modo da avere i recipienti a contatto con l'esterno e scaldare l'acqua nel becher fino ad ebollizione, dopo circa dieci minuti di ebollizione si ruota il rubinetto non facendo comunicare più i recipienti con l'esterno ma soltanto tra loro, facendo attenzione che non fuoriesca acqua dal recipiente C per effetto di una fluttuazione termica. Portato cosi il sistema all'equilibrio si prelevano 0,4ml di campione con la siringa e si chiude l'ago infilandolo in un piccolo tappo di gomma e si pesa la siringa con il suo contenuto; sempre mediante una bilancia tecnica si determina il peso di un becher vuoto che viene messo sotto il becco del recipiente C, avendo cosi l'apparecchiatura pronta si toglie il tappo all'ago della siringa e si inietta il campione nel recipiente con il tappo autosigillante, il liquido entrando nel recipiente vaporizza rapidamente spostando aria che determina la fuoriuscita dell'acqua dal recipiente C, la quale poi va a finire nel becher; si chiude nuovamente l'ago con il tappo, si pesa la siringa vuota e si pesa di nuovo il becher pieno controllando anche la temperatura ambiente tramite un termometro(T) che ci servirà per ricavare il peso molecolare.
Con i dati ricavati pesando la siringa, per differenza si avrà la quantità di sostanza che è stata iniettata (m), con i dati ricavati pesando il becher, sempre per differenza, ricaveremo la massa poiché la densità dell'acqua a temperatura ambiente può considerarsi 1g/ml, per cui la massa in grammi dell'acqua spostata coincide con il suo volume in millilitri.
Il volume dell'acqua(v) raccolta è uguale al volume occupato dall'aria, questa è legata al volume della sostanza vaporizzata(V') tramite la formula:
V' = v ∙ TH2O
Tamb
Ora per trovare il peso molecolare applichiamo la legge di stato dei gas perfetti:
PM = m ∙ R ∙ TH2O
V'
m = il peso in grammi del campioni ottenuto;
T = la temperatura in Kelvin dell'acqua all'ebollizione;
V'= il volume della sostanza vaporizzata;
Calcoli matematici: del Diclorometano (CH2Cl2):
V'= v ∙ TH2O ∕ Tamb = 125.49 ∙ 373 ∕ 293 = 159.75ml = 0.15975 L
PM = m ∙ R ∙ T ∕ V' = 0.46 ∙ 0.0821 ∙ 373 ∕ 0.15975 = 88.17
Calcoli matematici: dell'Acetone (CH3COCH3):
V'= v ∙ TH2O ∕ Tamb = 125.26 ∙ 373 ∕ 293 = 159.12ml = 0.15912 L
PM = m ∙ R ∙ T ∕ V' = 0.32 ∙ 0.0821 ∙ 373 ∕ 0.15912 = 61.58
Dati: del Diclorometano
|
Diclorometano |
m |
Diclorometano |
v |
||
|
Siringa piena |
5.01g |
0.46g |
Becher pieno |
225.36g |
125.49g |
|
Siringa vuota |
4.55g |
Becher vuoto |
99.87g |
||
|
Temperatura ambiente = 22°C = 293 K |
|||||
Dati: dell'Acetone
|
acetone |
m |
acetone |
v |
||
|
Siringa piena |
4,87g |
0.32g |
Becher pieno |
225.13g |
125.26g |
|
Siringa vuota |
4.55g |
Becher vuoto |
99.87g |
||
|
Temperatura ambiente = 22°C = 293 K |
|||||
Osservando i dati ottenuti da calcoli matematici si nota che i pesi molecolari ottenuti non sono uguali a quelli teorici in effetti per il diclorometano si è avuto un peso molecolare di 88.17 anziché 84.8, avendo così un errore del 4%, lo stesso è successo nell'acetone nel quale si è avuto un peso molecolare di 61.58 anziche 58 con un errore del 6%, Questi dati così imprecisi derivano dal fatto che abbiamo lavorato con strumenti che hanno un margine di errore, come la bilancia e i valori sono stati ricavati da una differenza di pesate e dalle temperature di ebollizione dell'acqua fissata a 373Kelvin ma poteva essere di poco diversa essendo stato un giorno con delle condizioni atmosferiche "pessime".
Nonostante queste incertezze essendo rimasti nel 10% dell'errore possiamo dire di aver operato abbastanza bene.
Purificazione di una sostanza liquida
eliminare le sostanze più volatili di una soluzione utilizzando il metodo della distillazione e sucessiva rettificazione.
Una delle tecniche maggiormente usate per la purificazione di un liquido è la distillazione. Essa consiste nell'eliminazione di quella impurezze contenute nel liquido in piccola percentuale che non evaporano alla stessa temperatura, cioè fornendo calore separa i composti di un miscuglio in base ai loro punti di ebollizione usando anche una colonna di rettifica.
Apparecchiatura per la distillazione semplice, cilindro graduato, becher, imbuto, pezzetti di pietra pomice, apparecchiatura per il frazionamento del distillato.
 Si prepara il materiale che consiste in un
mantello elettrico che scalda un pallone codato in cui va versato l'alcool
etilico servendosi di un imbuto ed evitando che vada a finire nel collo laterale,
si aggiungono dei pezzetti di pietra pomice per rendere regolare l'ebollizione,
e si chiude con un tappo porta termometro collocando il bulbo all'altezza del
collo laterale per misurare la temperatura corrispondente ai vapori che
condensano per ogni 10ml che ricaviamo, creando così una tabella. Al
collo laterale viene inserito un refrigerante (di Leebig), in cui viene fatta passare acqua, al termine
del refrigerante viene messo un cilindro per raccogliere il distillato. Si
accende il mantello elettrico e dopo qualche minuto i vapori cominciano a condensare in corrispondenza del tubo
laterale e del refrigerante finendo nel cilindro. La prima frazione di
distillato (la testa), contenente la maggior parte delle impurezze più
volatili, viene scartato come anche l'ultima frazione (la coda) in cui si sono
concentrate le impurezze meno volatili.
Si prepara il materiale che consiste in un
mantello elettrico che scalda un pallone codato in cui va versato l'alcool
etilico servendosi di un imbuto ed evitando che vada a finire nel collo laterale,
si aggiungono dei pezzetti di pietra pomice per rendere regolare l'ebollizione,
e si chiude con un tappo porta termometro collocando il bulbo all'altezza del
collo laterale per misurare la temperatura corrispondente ai vapori che
condensano per ogni 10ml che ricaviamo, creando così una tabella. Al
collo laterale viene inserito un refrigerante (di Leebig), in cui viene fatta passare acqua, al termine
del refrigerante viene messo un cilindro per raccogliere il distillato. Si
accende il mantello elettrico e dopo qualche minuto i vapori cominciano a condensare in corrispondenza del tubo
laterale e del refrigerante finendo nel cilindro. La prima frazione di
distillato (la testa), contenente la maggior parte delle impurezze più
volatili, viene scartato come anche l'ultima frazione (la coda) in cui si sono
concentrate le impurezze meno volatili.
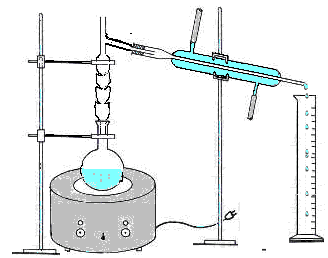 Si fa il frazionamento del distillato
ottenuto, non essendo tanto puro perché costituito da impurezze che hanno
tensione di vapore molto vicina a quella dell'alcol etilico utilizzando la
colonna di rettifica, che consiste in un tubo di vetro ad intervalli regolari
con serie di rientranze a punta disposte circolarmente; il vapore sale
attraverso la colonna dove si ha una parziale condensazione a causa della quale
il vapore abbandona i componenti meno volatili che ricadono nel pallone e
avvengono così una serie di condensazioni per tutta la colonna.
Si fa il frazionamento del distillato
ottenuto, non essendo tanto puro perché costituito da impurezze che hanno
tensione di vapore molto vicina a quella dell'alcol etilico utilizzando la
colonna di rettifica, che consiste in un tubo di vetro ad intervalli regolari
con serie di rientranze a punta disposte circolarmente; il vapore sale
attraverso la colonna dove si ha una parziale condensazione a causa della quale
il vapore abbandona i componenti meno volatili che ricadono nel pallone e
avvengono così una serie di condensazioni per tutta la colonna.
Il materiale usato consiste in un pallone chiuso dalla colonna di rettifica la quale viene chiusa da un tappo porta termometro, collocando il bulbo all'altezza del collo laterale per prendere la temperatura corrispondente ai vapori che condensano ogni 10ml. Ricaviamo dati e creiamo una tabella. Nel collo laterale viene inserito un refrigerante e si ha così una apparecchiatura simile a quella precedente.
|
Distillazione |
|
||||||||||
|
Temperatura (°C) |
|
|
|
|
|
|
|
|
|
|
|
|
Volume (ml) |
|
|
|
|
|
|
|
|
|
| |
|
Frazionamento |
|||||||||
|
Temperatura (°C) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
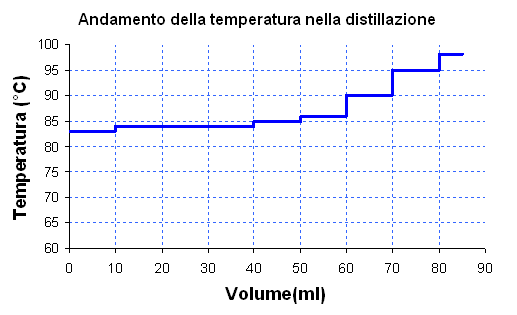
Nella distillazione semplice si osserva che la temperatura del vapore sale con un andamento continuo. Nella distillazione frazionata il vapore raggiunge una data temperatura che mantiene costante, e il pallone si impoverisce del componente leggero, procedendo la distillazione il vapore si arricchisce del componente (pesante) avente la temperatura di ebollizione più alta e quindi anche la temperatura del vapore aumenta vertiginosamente.
|
Costruzione di alcune pile |
cOSTRUIRE LE PILE: Zn ZnSO4 AgNO3 Ag
Cu CuSO4 AgNO3 Ag
Zn ZnSO4 ZnSO4 │Cu
Misurando la loro f.e.m. E OSSERVANDO L'EFFETTO DELLA CONCENTRAZIONE SULLA f.e.m. (LEGGE DI NERNST)
L'equazione di Nernst permette di calcolare il potenziale di una cella galvanica in condizioni di concentrazione diverse da quelle standard. Per una generica coppia redox, per la quale la reazione di riduzione sia:
p ox + ne- q rid
L'equazione di Nernst vale:
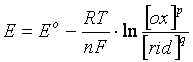
dove
E = potenziale in condizioni di concentrazione non standard
E° = potenziale standard
R = costante dei gas (8,31 J.mol-l.K-l)
T = temperatura assoluta
n = numero di elettroni scambiati
F = Faraday = 96.485 Coulomb (carica portata da una mole di elettroni)
ln = logaritmo neperiano o naturale (in base e = 2,7183)
[rid] = concentrazione della specie ridotta (eventualmente elevata al proprio coeff. stechiometrico)
[ox] = concentrazione della specie ossidata (eventualmente elevata al proprio coeff. stechiometrico)
A temperatura di 25°C il rapporto ![]() è una costante e trasformando il
logaritmo neperiano in un logaritmo in base 10, l'equazione diventa:
è una costante e trasformando il
logaritmo neperiano in un logaritmo in base 10, l'equazione diventa:
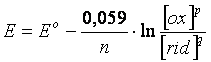
E' facile verificare che in condizioni standard, poichè [ox]p = [rid]q = 1N, il logaritmo vale zero e quindi:
E = E°
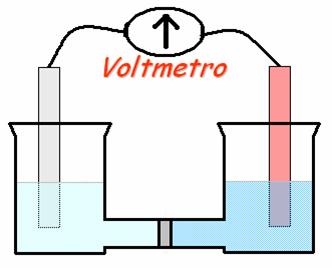
Tubo ad U con setto di vetro sinterizzato,
una soluzione CuSO4, una soluzione ZnSO4, ed una
soluzione AgNO3, a concentrazioni di circa 0,1M, elettrodi di Cu, Zn
e Ag, ed un voltmetro per la misura delle differenze di potenziale.
Si fissa il tubo ad U al sostegno e si versano 23ml delle soluzioni di solfato di rame e nitrato d'argento ciascuna in un ramo del tubo, riempiendoli contemporaneamente per evitare che la soluzione versata per prima passi attraverso il setto a causa dell'equilibrio idrostatico; si immergono gli elettrodi metallici nella loro soluzioni e si collega il voltmetro agli elettrodi misurando la f. e. m. ed "annotandola".
Passando alla costruzione della seconda pila il tubo a U si lava con acqua distillata e seguendo le modalità già illustrate, si mettendo solfato di zinco e nitrato di argento si annota anche qui la f.e.m. Ancora con lo stesso procedimento si costruisce anche la pila di Daniell versando solfato di rame e solfato di zinco, ma in questo caso mettendo 20ml, si misura la f.e.m. e si aggiungono alla soluzione contenente Cu²+ 20 gocce di una soluzione di ammoniaca ed agitando con una bacchetta si dà forma ad una soluzione di colore blu; si annota il valore della f.e.m. aggiungendo a tale soluzione acido solforico: si nota che la soluzione ritorna al colore che aveva prima e che la f.e.m. e cambiata di nuovo.
La forza elettromotrice della pila costruita potrà essere prevista calcolando la differenza tra il potenziale standard di riduzione del catodo e quello dell'anodo.
|
f.e.m. = E°catodo - E°anodo |
La pila Cu CuSO4 AgNO3 Ag il potenziale teorico dalla pila è:
![]()
La pila Zn ZnSO4 AgNO3 Ag
![]()
La pila di Daniell Zn ZnSO4 ZnSO4 │Cu
![]()
Zn ZnSO4 AgNO3 Ag Cu CuSO4 AgNO3 Ag
|
Dato sperimentale |
Dato teorico |
|
f.e.m 1.45+0,05 V |
f.e.m 1.56 V |
|
Dato sperimentale |
Dato teorico |
|
f.e.m 0.4+0,05 V |
f.e.m 0.46 V |
Zn ZnSO4 CuSO4 │Cu
|
Dato sperimentale |
Dato teorico |
Aggiunta di ammoniaca alla soluzione contenente Cu²+ |
Aggiunta di ac.solforico alla soluzione contenente Cu²+ |
|
f.e.m 1.05+0,05 V |
f.e.m 1.1V |
f.e.m 0.9+0,05 V |
f.e.m 1.05+0,05 V |
|
Equilibrio chimico a temperatura |
preparazione di una miscela di equilibrio n4O4 ⁄ no2 ed osservare la differenza di calore che la miscela presenta a 0°c e a 100°c, verificando l'equazione di van t'hoff.
![]() L'equazione
di van t'Hoff tiene conto della dipendenza della costante di equilibrio dalla
temperatura. All'aumentare della temperatura aumenta la costante di equilibrio
e al diminuire della temperatura diminuisce la costante di equilibrio.
L'equazione
di van t'Hoff tiene conto della dipendenza della costante di equilibrio dalla
temperatura. All'aumentare della temperatura aumenta la costante di equilibrio
e al diminuire della temperatura diminuisce la costante di equilibrio.
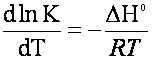
![]()
Tubo ad U munito di rubinetto, un frammento di rame metallico, un becker con del ghiaccio ed un altro becker con dell'acqua che verrà fatta bollire.
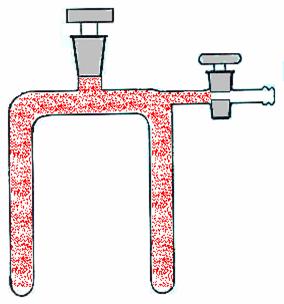 Nel tubo ad U si introduce un frammento di
rame metallico in uno dei due rami e mediante una pipetta si introduce 1ml
circa di acido nitrico concentrato nell'altro ramo, facendo con molta
attenzione affinché non vada a finire nella parte dove è posto il rame.
A questo punto viene collegato ad una pompa ad acqua in modo da creare il vuoto
al suo interno. Fatto il vuoto si chiude il rubinetto e si mette a contatto
l'acido nitrico con il rame lasciando che avvenga la reazione; si riempie un
bekcer con acqua e si porta ad ebollizione ed un secondo becker riempito con
ghiaccio ed acqua. Ora si è pronti per immergere i rami del tubo ad U
ciascuno in un becker lasciandoceli per qualche minuto per poi osservare
ciò che avviene.
Nel tubo ad U si introduce un frammento di
rame metallico in uno dei due rami e mediante una pipetta si introduce 1ml
circa di acido nitrico concentrato nell'altro ramo, facendo con molta
attenzione affinché non vada a finire nella parte dove è posto il rame.
A questo punto viene collegato ad una pompa ad acqua in modo da creare il vuoto
al suo interno. Fatto il vuoto si chiude il rubinetto e si mette a contatto
l'acido nitrico con il rame lasciando che avvenga la reazione; si riempie un
bekcer con acqua e si porta ad ebollizione ed un secondo becker riempito con
ghiaccio ed acqua. Ora si è pronti per immergere i rami del tubo ad U
ciascuno in un becker lasciandoceli per qualche minuto per poi osservare
ciò che avviene.
![]() Nell'esperienza si nota evidentemente la
reazione tra acido nitrico e rame la quale produce un gas bruno.
Nell'esperienza si nota evidentemente la
reazione tra acido nitrico e rame la quale produce un gas bruno.
Immergendo i rami del tubo ad U nei becker si è notato che il ramo immerso nell'acqua all'ebollizione, supposto a 100°C, il gas al suo interno era di colore rosso-bruno essendoci una elevata concentrazione di NO2 (Kp elevato, reazione spontanea a destra). Mentre il ramo immerso nel ghiaccio, supposto a 0°C il gas al suo interno era incolore essendoci una minore concentrazione di NO2 predominando la specie N2O4 (Kp più basso, reazione spontanea verso sinistra).
![]() L'equilibrio
gassoso N2O4 2 NO2 ha avuto un comportamento molto efficace per
questa esperienza, questo perché la reazione di dissociazione del tetrissimo di
azoto (N2O4) è una reazione endotermica
(∆H°>0) e comporta la rottura del legame N─N nella molecola N2O4
L'equilibrio
gassoso N2O4 2 NO2 ha avuto un comportamento molto efficace per
questa esperienza, questo perché la reazione di dissociazione del tetrissimo di
azoto (N2O4) è una reazione endotermica
(∆H°>0) e comporta la rottura del legame N─N nella molecola N2O4

![]()
![]()
![]()
![]()
![]()
Il diossido di azoto (NO2) ha le caratteristiche di una molecola radicale in quanto in essa è presente un elettrone non accoppiato che deriva dalla scissione osmotica del legame N─N. Il carattere di radicale della molecola NO2 ne giustifica non soltanto la grande reattività chimica ma anche il colore rosso-bruno.
Titolazioni Acido-Base
preparazione di una soluzione NaOH e determinazione della sua concentrazione mediante confronto con una soluzione a titolo noto di hcl.
La titolazione è un'operazione mediante la quelle è possibile determinare la quantità incognita di una sostanza facendola reagire in modo completo con una quantità nota di un'altra sostanza detta reattivo titolante. Per determinare la quantità incognita di una base si può usare come reattivo titolante una soluzione a concentrazione nota di un acido, o viceversa, nella titolazione al punto di equivalenza (viraggio) si ha:
Vacido ∙ Nacido = Vbase ∙ Nbase
Due burette da 50ml sostenute da un sostegno, due beute una da 100ml ed una da 250ml, due becker per gettare l'acido o la base in eccesso nelle burette, ed una vaschetta per il bagno d'acqua alla beuta contenente NaOH.
![]() Preparazione della soluzione NaOH.
Preparazione della soluzione NaOH.
Si pesa in un vetrino ad orologio 8g di soda in pastiglie, trasferendola con una spatola nella beuta da 250ml versandoci 200ml di acqua distillata e chiudendola con un tappo di gomma per evitare che la soluzione assorba CO2 dall'ambiente circostante, si agita fino allo scioglimento della soda sviluppando calore, cosi si fa un bagno caldo per qualche minuto, la soluzione approssimativamente 1M è pronta per la titolazione.
![]() Titolazione
della soluzione NaOH con una soluzione di HCl
Titolazione
della soluzione NaOH con una soluzione di HCl
Si posizionano le due burette, avvinate con le rispettive soluzioni, al sostegno ed si riempie una con una soluzione di HCl e l'altra con la soluzione di NaOH appena raffreddata a temperatura ambiente, passando cosi alla titolazione.
1°parte. Si mettono 15ml di soluzione NaOH nella beuta da 100ml si aggiunge una goccia di metilarancio (viraggio compreso tra pH=3 rosso e pH=4,5 giallo) e si fa cadere l'acido nella beuta mantenendo la beuta in continua agitazione per assicurare l'omogeneità del contenuto. In questa fase si deve osservare la soluzione che dal colore giallo passa al rosso arancio quando si raggiunge il punto di viraggio facendo attenzione di non oltrepassarlo, la soluzione diventa di colore rosso. Questa operazione viene ripetuta prelevando 30ml di NaOH.
2°parte. Si mettono 30ml di soluzione idrossido di sodio (NaOH) nella beuta da 100ml con 27ml di HCL si passa all'aggiunta di una goccia di fenolftaleina. Continuando ad aggiungere la soluzione titolante fino al raggiungimento del viraggio, in cui la soluzione diventa di colore rosa pallido.
3°parte. Si mettono 30ml di soluzione HCl nella beuta da 100ml si aggiunge una goccia di metilarancio; si fa cadere la soda nella beuta mantenendo la beuta in continua agitazione per assicurare l'omogeneità del contenuto. In questa fase si deve osservare la soluzione che dal colore giallo passerà al rosso arancio quando viene raggiunto il punto di viraggio.
Calcolo dei grammi per la preparazione di una soluzione NaOH 1M.
PMNaOH = 40 L = 200ml = 0.2l
M ∙ L = mol 1 ∙ 0.2 = 0.2mol
PM ∙ mol = g 40 ∙ 0.2 = 8g
1° parte. Calcolo della concentrazione della soda con aggiunta di metilarancio, con un errore dell'1%. Vacido ∙ Nacido = Vbase ∙ Nbase
|
NaOH |
HCl |
|
15 ml |
15,4 ml |
|
30 ml |
30,1 ml |
Nbase = Vacido ∙ Nacido = 15,4 ∙ 1 = 1,03 N
Vbase 15
Nbase = Vacido ∙ Nacido = 30,1 ∙ 1 = 1,00 N
Vbase 30
2° parte. Calcolo della concentrazione della soda con aggiunta della fenolftaleina, con un errore dell'1%. Vacido ∙ Nacido = Vbase ∙ Nbase
|
NaOH |
HCl |
|
30 ml |
30,5 ml |
Nbase = Vacido ∙ Nacido = 30,5 ∙ 1 = 1,01 N
Vbase 30
3° parte. Calcolo della concentrazione della soda con aggiunta della fenolftaleina, con un errore dell'1%. Vacido ∙ Nacido = Vbase ∙ Nbase
|
HCl |
NaOH |
|
|
|
Nacido = Vbase ∙ Nbase = 29,8 ∙ 1,01 = 1,00 M
Vacido 30
la media dei dati ricavati dalla 1° e 2° parte
Nbase = = 1,01+1,00+1,03 = 1,01 M
Dato teorico che dovevo ottenere:
g. NaOH = 8,04g PMNaOH = 40 L = 200ml
mol = g = 8,04 = 0.201 mol
PM 40
M = mol = 0,201 = 1.005 M
L 0,2
Durante la titolazione si nota come l'intervallo di viraggio sia facilmente oltrepassabile perché per l'aggiunta di piccole quantità di titolante sono molto grandi le variazioni di pH in prossimità dell'equivalenza, per questo si è usato indicatori con pK compreso tra 4 e 10, ottenendo dei valori apprezzabili. Nel caso della fenolftaleina si nota che non è stata aggiunta subito ma dopo l'aggiunta di un po' di acido, questo perché avendo un intervallo compreso tra pH 8 e 10 il suo viraggio è a pH 9 a causa della sua relativa instabilità in soluzioni fortemente basiche.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta