| biologia |
|
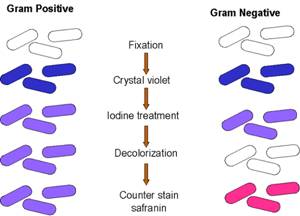
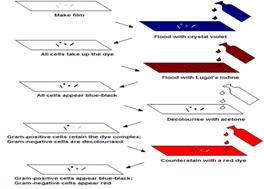
COLORAZIONE GRAM
E' una tecnica di colorazione introdotta da C. Gram nel 1884 e tutt'oggi praticata con le stesse modalità. E' anche detta differenziale, perché impiega più di un colorante a differenza delle colorazioni semplici.
1ª fase → si usa il cristal violetto per 2-3 minuti, questo colorante colora il cellule - NUCLEO, CITOPLASMA, RIBOSOMI, PARETE CELLULARE, CAPPARATO DI GOLGI, ITOSCHELETRO, APPARATO DI GOLGI" class="text">citoplasma di tutte le
cellule di color viola, in quanto è in grado di entrare in qualsiasi tipo di cellula.
2ª fase → le cellule sono trattate con una soluzione che contiene iodio. L' unione di iodio e cristal
violetto fa complessate le cellule, cioè laddove c'è unione si forma un complesso più
grande che non è più in grado di uscire dalla cellula. Si fissa in questo modo il colore.
3ª fase → si tratta con un decolorante ( alcol etilico o acetone)
4ª fase → si usa un secondo colorante, la safranina rossa. A questo punto avviene la classificazione:
Gram + , conservano la colorazione viola
Gram - , perdono la colorazione viola e si colorano con la safranina in rosso. In questo modo sono distinguibili in microscopia.
A parte la colorazione qual è la differenza tra i due?
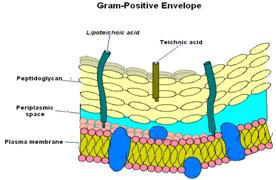
La differenza risiede a livello della struttura esterna.
La parete dei gram + appare al microscopio elettronico come uno strato unico, continuo e spesso. E' formata principalmente da peptidoglicano, disposto su più strati ed è associato a molecole di acidi teicoici. Quest'ultimi posti sulla superficie esterna del peptidoglicano svolgono funzioni antigenica.
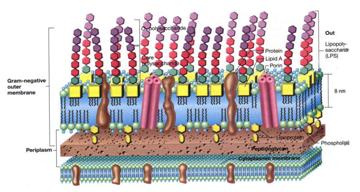
La parete dei gram -, invece, appare al microscopio elettronico pluristratificati, a ridosso della membrana cellulare in una matrice più chiara, detta periplasma, c'è una sottile linea di peptidoglicano. Quest'ultima pur essendo formata dalla stessa molecola è più sottile; può inoltre, sono dotati di una seconda membrana, la membrana esterna, ( importante per il vaccino), al cui interno sono immerse proteine neosintetizzate da un batterio.
- Perché quando effettuiamo, dopo la colorazione, il lavaggio con l'alcol esce il colorante?
La cellula si disidrata con l'alcol, ciò provoca un compattamento del peptidoglicano:
Se lo strato è spesso → il colorante non riesce a superare l'impedimento
(peptidoglicano compattato)
Se lo strato è esile → il trattamento con alcol provoca il rilascio del colorante
Ciò vale per tutti i tipi di colorazione.
- Funzione della parte
E' una struttura molto importante per la fisiologia del batterio e per la sua azione patogena.
E' in grado di attivare il sistema immunitario ed uccidere la cellula.
Per capire come funziona la struttura della parete, si ricorre al lisozima (contenuto nelle
lacune), appartiene alle difese immunitarie aspecifiche, cioè non bersaglia un particolare
batterio. Agisce su tutto e in particolare, è in grado di tagliare il peptidoglicano, frammentando
così la parete cellulare. Si creano in questo modo delle discontinuità; la cellula è immersa in
una soluzione ipotonica, cioè a bassa concentrazione di soluti. Di conseguenza per il principio
osmotico c'è una migrazione di acqua dall'esterno all'interno. Tuttavia in natura tutti gli
squilibri tendono ad essere portati all'equilibrio. Supponiamo di avere due timenti a
differente concentrazione, separati da una membrana permeabile con pori larghi: i soluti vanno
da max a min concentrazione per ristabilire l'equilibrio. Nella cellula la membrana è però
semipermeabile, in questo caso viene consentito il passaggio solo di acqua, ossigeno e anidride
carbonica (responsabili degli scambi gassosi, per i quali non richiedono l'intervento di proteine)
e urea, in qualità di sostanza di rifiuto del catabolismo. Tutto il resto ha necessariamente
bisogno per passare, di proteine mediante un trasporto facilitato ( non richiede consumo di
energia) o mediante un trasporto attivo ( richiede consumo di energia + proteine es. pompe
sodio-potassio). Ipotizziamo di avere una membrana semipermeabile, perché c'è la tendenza a
bilanciare le due concentrazioni, se il soluto non può muoversi, è il solvente (acqua) che si
sposta e va da min a max concetrazione per aumentare il volume della zona e renderla uguale
alla concentrazione dell'altra zona.
Se, invece, la parete è integra si oppone all'ingresso di acqua, cioè è dotata di una forza per
opporsi alla pressione dell'acqua. Questa pressione è tanto più forte, quanto più è elevata la
differenza di concentrazione. Se usiamo lisozima, questo è in grado di frammentare la parete
cellulare, il risultato è che dove non c'è più opposizione l'acqua entra, il citoplasma si espande,
e si ha una lisi osmotica.
Da ciò si può dedurre che la funzione della parete è di opporsi all'entrata di acqua; se invece, ci
troviamo in acqua marina,la soluzione è iperosmotica, al contrario, bisogna far fronte all'uscita
di acqua; se , ancora la soluzione è ipotonica (uguale concentrazione di soluti e solventi) la
parete è frammentata, ma non c'è lisi perché non c'è il passaggio di acqua e la cellula può
sopravvivere in quest' ambiente.
- Escludendo gli ambienti ipotonici dove possono vivere?
In altre cellule, sono parassiti, per lo più patogeni, che devono vivere in latre cellule, es.
micoplasmi. Sono definiti patogeni emergenti in quanto privi di parete; poiché il bersaglio di
alcuni antibiotici è proprio la parete, in loro presenza, il batterio non muore.
- Struttura del peptidoglicano
E' riconducibile al nome stesso : pepti ( parte proteica) + glicano ( parte carbonica)
La parte glicanica è costituita da due carboidrati: · N-acetil-glucosammina
(NAG)
· Acido N- Acetil- Minamico
(NAM)
I due carboidrati sono legati tra loro con un legame β - 1,4- glicosidico. Tale legame è il bersaglio del lisozima che taglia i legami e distrugge il peptidoglicano
Il NAG e il NAM sono strutture ad anelli che si alternano all'interno del peptidoglicano.
I vari strati sono tenuti insieme dalla parte proteica.
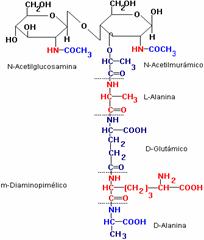
Il primo aa è una N-alanina, il carbonio è una molecola chinale perché contiene tutti e quattro i
sostituenti. Nell'N-Acetil-D-Glucosamina il gruppo anidridico dell'atomo di carbonio α è
costituito da un gruppo amminico acetilato. L'acido N-Acetil-Munamico è derivato dalla N-
Acetil-D-Glucosammina mediante legame etere con l'acido D-lattico a 3 atomi di carbonio.
O
|
H-C-CH3 E' un residuo di acido lattico che si lega al carbonio (C=O) del primo aa.
Caratteristica interessante è la presenza di aa nella conurazione di tipo D, rara nelle strutture
biologiche. Tutte le proteine sono infatti formate da aa di tipo α.
- Conurazione D → viene assegnata sulla base della D-Gliceraldeide
CHO
![]()
![]() H OH D-Gliceraldeide
H OH D-Gliceraldeide
CH2OH
Un D-monosaccaride, in generale, ha l'-OH sul penultimo carbonio a destra.
- Conurazione L → viene assegnata sulla base della L-Gliceraldeide
CHO
![]()
![]() HO H L-Gliceraldeide
HO H L-Gliceraldeide
CH2OH
Un L-monosaccaride ha l'-OH sul penultimo carbonio a sinistra.
- Perché gli aa hanno conurazione D?
I ribosomi sintetizzano aa di tipo L; di conseguenza i legami peptidici vengono
sintetizzati in modo non ribosomiale.
- Qual è il vantaggio a produrre L e trasformarli in D?
Esistono delle proteasi, esoenzimi, in grado di degradare le proteine; se la parete
contiene solo aa di tipo L è facilmente soggetta a proteasi. Quest'ultime riconoscono
solo legami L, l'inserimento di aa di tipo D va a preservare la struttura della parete.
Hanno quindi una funzione difensiva; gli aa di tipo D sono presenti anche nella parete
dei funghi.
Il terzo aa, è un meso-diamina-pilenico. Ha due carboni chirali (si parla in questo caso di DD),
due gruppi amminici + 2 carbossilici. E' versatile, ha, inoltre, due peptidi che formano un ponte
con gli aa di uno strato successivo.
Il quarto aa è una D-alanina. In questo caso il peptide è prodotto come precursore, ci dovrebbe
essere un'altra D-alanina ( quinto aa) che viene eliminata.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta