| biologia |
|
|||||
|
Per una visione aggiornata del mercato immunologico Anticorpi e immunoreagenti
Negli ultimi anni, l'offerta di prodotti e servizi
immunologici è cresciuta a dismisura.
Sono disponibili anticorpi specifici per un numero sempre maggiore di antigeni,
solubili, immobilizzati (a piastre, resine o membrane) coniugati e non
Inoltre, il continuo ampliamento della gamma di sistemi di rivelazione dei
complessi antigene-anticorpo, unitamente al miglioramento della loro
sensibilità, hanno contribuito ad estendere enormemente
le potenzialità ed il campo di applicabilità delle reazione e
delle tecniche immunologiche.
Senza la possibilità di disporre di anticorpi come mezzi potentissimi di rivelazione specifica di proteine, acidi nucleici, virus, batteri., gran parte dei progressi e delle scoperte della biologia non avrebbero avuto luogo. Data l'indiscussa importanza e la diffusione di utilizzo di anticorpi e di immunoreagenti nei settori più diversi, crediamo sia utile fare una panoramica (che sarà necessariamente incompleta vista la vastità dell'offerta) delle caratteristiche e delle potenzialità applicative dei vari prodotti attualmente presenti sul mercato. Per la maggior parte delle tecniche che fanno uso di anticorpi esistono in commercio i singoli prodotti oppure dei kit completi che includono tutti o quasi i reagenti richiesti per una particolare procedura, unitamente ai protocolli raccomandati. Anticorpi primari e secondari, tecniche di coniugazione, sistemi di rivelazione dei complessi antigene-anticorpo e servizi offerti dalle aziende in questo settore saranno tra gli argomenti principali dell'articolo.
Anticorpi monoclonali
o policlonali?
Gli anticorpi o immunoglobuline (. 1) secreti in vivo in risposta
all'immunizzazione con uno o più antigeni sono policlonali, perché
vengono stimolate diverse cellule B che riconoscono regioni o epitopi
differenti sull'antigene immunogeno. Si possono produrre antisieri in un'ampia
gamma di animali (topo, ratto, coniglio, capra).
In genere, si fanno due o più iniezioni di antigene insieme a un
adiuvante (un agente che potenzia in modo aspecifico la risposta immunitaria)
e, per piccole molecole, con un carrier (che porta i determinanti riconosciuti
dalle cellule T helper, che 'aiutano' la risposta anticorpale). Dopo
ripetute immunizzazioni, gli anticorpi prodotti saranno essenzialmente IgG; per
eliminare gli anticorpi di specificità indesiderate, si può far
adsorbire l'antisiero.
Diversamente dai policlonali, gli anticorpi monoclonali (MAb)derivano da un
singolo clone di cellule B (che produce anticorpi di una sola
specificità).
Il modo più diretto di produrre anticorpi monoclonali è la
tecnica degli ibridomi di Kohler e Milstein (vedi riquadro). Alternativamente,
le cellule B umane possono essere immortalizzate usando il virus Epstein-Barr
(EBV) e poi clonate, per produrre anticorpi monoclonali umani.
Per la produzione commerciale di MAb, le cellule possono essere coltivate in
bioreattori che permettono alle cellule di crescere ad alte densità,
secernendo attivamente grandi quantità di anticorpo (parecchi
grammi/settimana).
Gli anticorpi monoclonali forniscono reagenti con una singola
specificità in quantità potenzialmente illimitata.
Gli anticorpi policlonali contengono invece molteplici specificità ma la
loro quantità è generalmente limitata dall'ammontare di siero che
si riesce ad ottenere dall'animale immunizzato. Bisogna dire però che,
da animali iperimmunizzati di taglia intermedia come ad esempio il coniglio, si
riesce ad ottenere abbastanza siero per raggiungere un titolo anticorpale
sufficiente per alcuni anni. (Ricordiamo che il titolo di un anticorpo indica
la più bassa concentrazione [o la più alta diluizione] che
è ancora efficace in un dato saggio, ad esempio l'agglutinazione, ossia
la formazione di aggregati insolubili tra anticorpi e antigeni cellulari o
comunque particolati).
Anche se può sembrare strano, gli anticorpi policlonali possono talvolta
fornire una specificità maggiore di quella di anticorpi monoclonali
diretti contro lo stesso antigene. Questo perché da un siero policlonale si
riescono ad eliminare problemi di cross-reazioni indesiderate mediante
adsorbimento con l'antigene che verso cui si verificano tali cross-reazioni.
Nessuna cross-reazione può essere invece eliminata da una soluzione di
anticorpo monoclonale, perché questo è dotato di una singola
specificità. La specificità degli anticorpi policlonali
può anche essere aumentata mediante cromatografia di affinità
usando l'antigene purificato.
Tecniche di rilevazione di antigeni e anticorpi
Esistono un gran numero di tecniche immunologiche per rivelare e/o quantificare
antigeni o anticorpi.
Quando si tratta di antigeni e anticorpi solubili, i saggi si basano sulla
marcatura di uno dei reagenti, sulla formazione di immunocomplessi che
precipitano, o sulla misurazione di una funzione effettrice dell'anticorpo come
l'agglutinazione o la fissazione del complemento.
Tra i metodi disponibili rientrano l'ELISA (enzyme-linked immunoadsorbent
assay) e il RIA (radioimmunoassay). C'è poi l'immunoprecipitazione su
gel che comprende vari saggi che si basano sulla diffusione di uno
(immunodiffusione radiale singola) o entrambi i reagenti (immunodiffusione
doppia), sulla separazione elettroforetica dell'antigene seguita da diffusione
dell'anticorpo (immunoelettroforesi).
Se gli antigeni o gli anticorpi sono intracellulari o legati alla membrana, si
possono usare diverse procedure, alcune delle quali sono simili a quelle
utilizzate per la rivelazione di antigeni solubili. L'immunofluorescenza
è un metodo ampiamente utilizzato per sispensioni di cellule, cellule
aderenti in monostrato e sezioni di tessuti; essa permette di attribuire un
dato antigene a una data cellula (e magari anche ad un determinato
sottotimento interno) e necessita di un microscopio a fluorescenza o di
un citofluorimetro di flusso.
L'immunoistochimica è un buon metodo per la rivelazione di antigeni
associati alle cellule in sezioni di tessuti, mentre la tecnica immunogold
(basata su anticorpi marcati con oro) permette una localizzazione molto precisa
dell'antigene all'interno di cellule e tessuti, se combinata con la microscopia
elettronica.
Caratterizzazione degli anticorpi
Le principali caratteristiche che bisogna stabilire di un anticorpo (e che le
aziende devono accuratamente verificare prima di poter vendere un anticorpo)
sono la classe della catena pesante e di quella leggera, la specificità
antigenica, la specificità per l'epitopo, e l'affinità.
La classe e la sottoclasse si possono determinare con anticorpi specifici per
le singole classi o isotipi (mediante tecniche ELISA, RIA, di immunodiffusione
radiale).
Quasi sempre la specificità di un anticorpo che prodotto è nota,
ma la sua cross-reattività può non esserlo. È importante
accertare che il sistema che si intende utilizzare non presenti cross-reazioni
indesiderate. Ciò si può verificare sottoponendo a screening
contro pannelli rilevanti di anticorpi, antigeni e/o tessuti (mediante RIA,
ELISA, immunodiffusione, immunofluorescenza, immunoistochimica).
Se si dispone di più di un anticorpo monoclonale contro un dato
antigene, è spesso preferibile determinare se riconoscono lo stesso
epitopo o epitopi diversi sull'antigene. Ciò è importante se si
vogliono ad esempio utilizzare due anticorpi monoclonali in un saggio sandwich,
dato che questi devono riconoscere epitopi differenti. Lo screening si
può fare con un test ELISA per inibizione o sandwich: se con questi
approcci si rivelano nuove specificità può essere utile definire
ulteriormente l'epitopo riconosciuto. Nel caso di epitopi discontinui, si
possono generare frammenti di antigene mediante taglio con enzimi proteolitici
o attraverso le tecniche del DNA ricombinante, e si può analizzare la
reattività dei MAb contro i frammenti usando test ELISA e immunoblotting.
Infine, l'affinità di un anticorpo è un'altra caratteristica
importante da determinare, anche se è di difficile misurazione e
può variare in funzione del metodo usato.
Anticorpi primari
Preparazione
Per iperimmunizzare gli animali ospiti (in genere, capre, topi, conigli, ratti
e pecore) si usano antigeni altamente purificati, la maggior parte dei quali
sono isolati da plasma, da siero o da lisati cellulari usando varie procedure
cromatografiche (filtrazione su gel, cromatografia a scambio ionico e bioaffinità).
Tra gli anticorpi primari presenti in commercio rientrano antisieri per diverse
applicazioni (antisieri specifici, per immunostaining, per applicazioni
forensi), frazioni IgG,, frammenti Fab e F(ab')2, anticorpi purificati per
affinità e anticorpi monoclonali.
Gli anticorpi per applicazioni forensi sono antisieri specifici anti-siero
intero ulteriormente processati attraverso adsorbimento per affinità per
rimuovere gli anticorpi che cross reagiscono con altre specie comuni
Le frazioni IgG sono preparate da antisieri specifici in genere mediante
precipitazione in solfato di ammonio e cromatografia a scambio ionico, filtrate
e liofilizzate. Solitamente, non vengono aggiunti conservanti per permetterne
l'uso diretto in saggi con cellule 'in vivo' e per marcatura
radioattiva e coniugazione)
I frammenti Fab e F(ab')2 sono preparati da frazioni IgG specifiche mediante
digestione controllata con papaina e con pepsina, rispettivamente (. 2).
Sono purificati mediante cromatografia, dializzati, filtrati e liofilizzati,e
sono generalmente privi di conservanti
Gli anticorpi purificati mediante cromatografia di affinità vengono
preparati da frazioni IgG specifiche mediante immunoadsorbimento su antigeni in
fase solida, dilizzati, filtrati, senza aggiunta di conservanti.
Infine, ci sono gli anticorpi monoclonali, venduti sotto forma di asciti o di
supernatanti di colture cellulari oppure di anticorpi monoclonali purificati.
Gli ibridomi di topo sono in genere prodotti fondendo cellule di mieloma e
cellule di milza di topi Balb/C immunizzati con un antigene purificato. Le
cellule clonate dagli ibridomi sono iniettate in topi per produrre asciti o
sono fatte crescere in coltura per produrre supernatanti. Asciti e supernatanti
sono chiarificati mediante centrifugazione e filtrazione, mentre per produrre
anticorpi monoclonali purificati si usa cromatografia di affinità
utilizzando proteina A o proteina G. Tutte e tre le forme di anticorpi
monoclonali commercializzate contengono in genere conservanti.
Specificità e purezza
Per specificità si intende la specificità per l'antigene e per la
specie.
La maggior parte dei prodotti in commercio sono testati attraverso tecniche di
immunoelettroforesi per verificarne la specificità, utilizzando
controlli sia positivi che negativi. Gli anticorpi monoclonali e per
immunostaining sono testati anche in immunoblotting, immunostaining di cellule
o tessuti e/o in ELISA.
Per quanto riguarda la specie-specificità, i prodotti contrassegnati
'no cross species' non hanno mostrato cross reattività in
immunoelettroforesi con le IgG delle specie indicate.
L'analisi della purezza varia a seconda del tipo di anticorpo. Le frazioni IgG
in commercio, come anche gli anticorpi purificati per affinità, non
presentano tracce di albumina.
I frammenti Fab e F(ab')2 sono testati con siero e IgGFc anti-specie ospite:
per privarle completamente di IgG intere, di frammenti Fc o di altre proteine
del siero.
Gli anticorpi monoclonali purificati sono testati su gel SDS riducente, in modo
da ottenere una purezza del 97-99%).
L'agente conservante Sodio Azide (NaN3) spesso aggiunto alle soluzioni di
anticorpi può essere facilmente rimosso mediante dialisi.
Campi di applicazione
Gli anticorpi primari e relativi reagenti trovano applicazione in vari campi
della ricerca, della diagnostica e delle analisi in genere. Le società
produttrici più serie offrono anticorpi e immunoreagenti ottimizzati per
le singole applicazioni.
Gli anticorpi per Biologia Cellulare sono ottimizzati per le applicazioni
più frequenti in questo campo (saggi di immunoblotting e per la
localizzazione immunoistologica di proteine in sezioni di tessuti e cellule in
coltura). Tra gli anticorpi per Biologia Cellulare rientrano quelli specifici
per proteine e componenti del citoscheletro, per molecole di adesione, per
antigeni cellulari umani, per proteine coinvolte nel ciclo celluare e proteine
nucleari. Citiamo tra questi dei nuovi anticorpi commerciali specifici per le
proteine del ciclo cellulare, che permettono di condurre studi di
differenziazione, oncogenesi, trasduzione del segnale e apoptosi. Questi
anticorpi purificati per affinità, altamente specifici, sono disponibili
per i membri di tre classi di proteine molto importenti nel ciclo cellulare:
cicline, chinasi ciclina-dipendenti (CDK) e inibitori delle CDK. Adatti per
immunoprecipitazione, Western blotting e immunofluorescenza, questi anticorpi
sono prodotti contro singoli peptidi in modo da massimizzarne la
specificità e permettere esperimenti di competizione con il peptide
(. 3)
Gli anticorpi per applicazioni nel campo delle Neuroscienze sono diventati dei
mezzi sempre più importanti per studiare lo sviluppo, il
differenziamento e la localizzazione di cellule neuronali e non nel sistema
nervoso centrale (CNS) e in quello periferico.
Un altro campo applicativo è quello della citoluorimetria di flusso.
La marcatura fluorescente di antigeni di superficie permette di analizzare e
'sortare' diverse popolazioni di leucociti a seconda dell'
intensità di fluorescenza e delle proprietà di scattering della
luce. L'analisi mediante immunofluorescenza multicolore di sottopopolazioni
leucocitarie non è mai stata così facile, grazie alla
disponibilità di anticorpi coniugati con fluorocromi diversi.Gli
anticorpi commerciali per analisi in citofluorimetria di flusso (ottimizzati
per questo tipo di applicazione) includono anticorpi contro gli antigeni CD
umani e murini e i loro coniugati, anticorpi secondari coniugati a fluorocromi
e vari controlli.
Anche nel campo sempre più di moda della Biologia Molecolare, l'uso di
anticorpi sviluppati per aiutare l'identificazione di proteine di fusione e per
la rivelazione di sonde DNA/RNA. Questi reagenti possono essere utilizzati in
ELISA, immunoblotting e immunocitochimica.
Anticorpi secondari e coniugati
Gli anticorpi secondari specifici per immunoglobuline umane e animali sono
venduti generalmente come asciti, anticorpi purificati per affinità,
frazioni IgG e antisieri. Sono sviluppati in topo, ratto, capra o pecora,
utilizzando proteine purificate come immunogeni.Gli antisieri anti-topo (anti-
catena pesante) sono ad esempio sviluppati in pecora o capra usando come
antigeni immunogeni proteine monoclonali o proteine di mieloma purificate. I
prodotti specifici per la catena pesante sono adsorbiti, mediante tecnice di fase
solida, per ottenere la specificità voluta e testati per eventuali
cross-reattività.
Il metodo più utilizzato per la rivelazione dell'avvenuto legame
antigene-anticorpo secondario consiste nella coniugazione dell'anticorpo (o
anche dell'antigene) con una molecola che può essere direttamente
rivelata. Questa molecola può essere un enzima, un fluorocromo, un
radioisotopo (soprattutto 125I ma anche
Per alcune applicazioni viene ampiamente utilizzata la marcatura biosintetica,
ossia l'incorporazione stabile di un aminoacido marcato (35S metionina, 3H
lisina, 3H arginina, 3H leucina o 3H fenilalanina), tecnica che ha il vantaggio
di non necessitare di una reazione di accoppiamento chimico che potrebbe
danneggiare l'anticorpo. La marcatura biosintetica necessita di far crescere le
linee cellulari che producono un dato MAb in un terreno privo dell'aminoacido
usato per la marcatura. I problemi di questa tecnica sono la relativamente
bassa attività specifica e l'inapplicabilità ad anticorpi
policolonali.
Gli anticorpi coniugati, indipendentemente dalla molecola marcatore utilizzata,
sono preparati da frazioni IgG di antisieri o da anticorpi purificati per
affinità e sono purificati mediante gel filtrazione. Sono adatti per un
gran numero di tecniche immunologiche tra cui ELISA, citofluorimetria di
flusso, immunoistochimica e immunoblotting. La scelta del tipo di marcatura
dipende in gran parte dal tipo di saggio per cui l'anticorpo dovrà
essere utilizzato.
Anticorpi coniugati ad enzimi
Gli enzimi i più utilizzati sono quelli che causano un cambiamento di
colore di un substrato, come l'enzima perossidasi di rafano (Horse Radish
Peroxidase, HRP) o forfatasi alcalina (alcaline phosphatase, AP).
Gli anticorpi coniugati ad enzimi sono adatti per saggi EIA, ELISA,
immunostaining di cellule e tessuti in microscopia ottica ed elettronica e per
immunostaining di blot o immunoblotting.
Anticorpi coniugati a fluorocromi
Tra i fluorocromi la fluoresceina isotiocianato (FITC) è la molecola
d'elezione per studi di immunofluorescenza (immunofluorescence assay, IFA),
dato che la procedura di coniugazione è estremamente semplice e il
segnale emesso è relativamente forte. In caso di analisi a due colori,
sono ampiamente utilizzati anche i fluorocromi tetrametilrodamina isotiocianato
(TRITC), il Texas Red TR) o la ficoeritrina (PE). Altre applicazioni degli
anticorpi coniugati oltre ai saggi IFA, sono lo staining di cellule e tessuti
(rilevabile con la microscopia in fluorescenza), immunoblotting e staining di
cellule per cell sorting.
Anticorpi biotinilati
Il sistema di marcatura avidina:biotina si basa sull'elevata affinità di
legame (Ka=1015) dell'avidina per la biotina (vitamina H). Ma oltre all'avidina
è stata purificata anche una molecola simile, la streptavidina, che
presenta un minore background, nonché alcune varianti dell'avidina con
caratteristiche ottimizzate.
L'elevata affinità di legame avidina-biotina è utilizzata nei
saggi immunologici coniugando proteine come gli anticorpi alla biotina (biotinilazione)
e coniugando molecole reporter come enzimi e fluorocromi all'avidina. Le
applicazioni della marcatura avidina-biotina, per cui è anche
disponibile un gran numero di kit più o meno completi, includono enzyme
immunoassays (EIA), immunostaining di cellule e tessuti, immunoblotting,
citofluorimetria di flusso. In ura 5 è mostrato un esempio idei
risultati che si ottengono con un kit per immunostaining contente anticorpi
biotinilati rivelati con un sistema di streptavidina coniugata ad enzimi.
Anticorpi coniugati a oro
L'oro è un marcatore denso agli elettroni che viene utilizzato per la
rivelazione/quantificazione di proteine, antigeni e acidi nucleici. Attraverso
una forte interazione non covalente, l'oro può essere coniugato ad
anticorpi per l'impiego in saggi immunologici. L'oro coniugato ad anticorpi
è utilizzato in procedure di microscopia elettronica e ottica e di
immunoblotting. I coniugati anticorpo-oro colloidale consistono in una
sospensione di particelle d'oro rivestite da molecole di un dato anticorpo
(. 6). Tali particelle possono essere di dimensioni comprese tra 1 e 250 nm.
In questi saggi, il colore rosso dell'oro accumulato è visibile su una
membrana nel punto cui l'antigene è stato immobilizzato, oppure in soluzione,
dove l'oro permette una rivelazione estremamente sensibile di quantità
di proteine inferiori al nanogrammo.
La disponibilità di una così ampia gamma di dimensioni è
importante, perché permette di studiare antigeni in microscopia a molti
ingrandimenti diversi e permette la marcatura multipla di antigeni in sezioni
di tessuto.
In microscopia elettronica le particelle d'oro sono visibili senza alcun
ulteriore trattamento, mentre per analisi in microscopia ottica o per la
rivelazione a occhio nudo rivelazione dell'antigene necessitano di una breve
procedura di potenziamento mediante Silver per aumentare notevolmente la
sensibilità del saggio.
Proteina A e proteina G
La proteina A di Staphylococcus e la proteina G di Streptococcus si legano al
frammento Fc delle catene pesanti. Bisogna sempre tenere presente però
che non tutte le classi di anticorpi legano questi ligandi (le IgG1,IgG2, e
IgG4 umane e le IgG2a, IgG2b e IgG3 murine legano fortemente la proteina A,
tutte le 4 sottoclassi di IgG umane legano fortemente la proteina G, mentre
solamente le IgG1 di topo mostrano un debole legame).
In commercio è disponibile una buona scelta di reagenti proteina A e
proteina G in forma solubile e insolubile per una varietà di
applicazioni tra cui: purificazione di anticorpi e saggi EIA di diverso tipo.
La proteina A e la proteina G purificate sono accoppiate a differenti matrici
per l'impiego come resine di affinità. Sul mercato esiste anche una
proteina A ricombinante che rappresenta un nuovo metodo per la purificazione
proteica (. 7).Le proteina A e G .sotto forma di coniugati con enzimi (AP o
HRP) e fluorocromi (FITC, TRITC, PE, TR) sono un'alternativa agli anticorpi
secondari marcati universali per la localizzazione/visualizzazione delle
immunoglobuline.
Reagenti di coniugazione
Le aziende offrono una scelta vastissima di anticorpi già coniugati ad
una quasi altrettanto vasta gamma di molecole marker. Se, per risparmiare o
perché si necessita di un anticorpo coniugato non disponibile in commercio, si
procede personalmente alla coniugazione, sono disponibili reagenti, enzimi e
flurocromi adatti allo scopo della marcatura.
Kit e substrati enzimatici
Il substrato dei coniugati enzimatici varia innanzitutto a seconda del tipo di
enzima utilizzato, e poi in base al tipo di applicazione (test su micropiastra,
blotting su membrana e immunoistochimica).
Substrati e kit per saggi ELISA/EIA in micropiastra
La scelta del substrato deve sempre tener conto del fatto che la
sensibilità del saggio non è la stessa sensibilità
dell'enzima substrato. La sensibilità di un saggio è definita
come la più piccola quantità di antigene che può essere
rivelata. La sensibilità di un substrato è la misura della
quantità di colore generata da un'unità di enzima. In un dato
saggio in cui la quantità di materiale è molto limitata, la
sensibilità dell'immunodosaggio può essere limitata dalla
quantità di colore generata dal substrato.
Per anticorpi coniugati a fosfatasi alcalina si usa in genere il substrato pNPP
(p-Nitrophenylphosphate) che sviluppa un intenso colore giallo misurabile a
405-410 nm.
Per anticorpi o streptavidina coniugati a perossidasi si può scegliere
tra diversi substrati
Il substrato ABTS perossidasi che sviluppa un colore blu-verde intenso
misurabile tra 405 e 410 nm. Oppure il substrato TMB perossidasi che offre
un'altissima sensibilità in ELISA in micropiastra; la rapida
velocità di reazione ne consente anche l'impiego in saggi cinetici o
endpoint. Produce un colore blu scuro misurabile a 650 nm. In ura 8 è
rappresentato un saggio EIA su micropiastra che utilizza TMB come substrato di
streptavidina coniugata a perossidasi
Un'alternativa molto interessante è rappresentat dalla
disponibilità commerciale di substrati e kit per la rivelazione
chemiluminescente in micropiastra di anticorpi e sonde marcati con perossidasi.
Substrati per immunoblotting
Il substrato fornisce un metodo per la rivelazione visiva dell'enzima nel
coniugato. La scelta dipende dalle richieste del saggio e dalle preferenze
personali dell'utilizzatore. nessun substrato è ottimale per tutti i
saggi di blotting. Data la disponibilità commerciale di un gran numero
di substrati diversi, è possibile lo staining multiplo della stessa
membrana.
Per anticorpi o streptavidina marcati con fosfatasi si usa solitamente il
substrato BCIP/NBT (5-bromo-4-chloro-3-indolyl-phosphate/nitroblue tetrazolium)
che offre alta sensibilità e basso backgound sulle membrane; esso
produce un intenso precipitato color porpora al sito di reazione, la
colorazione che si ottiene è molto stabile e resiste al fading quando
esposta alla luce.
Per la rivelazione di anticorpi o streptavidina marcati con perossidasi si
possono usare il già citati TMB, oppure il substrato 4CN (4
chloro-l-naphtol) che è una valida alternativa ad altri substrati magari
più sensibili ma con cui c'è il problema del backgound.
In ura 9 sono mostrati dei blot che utilizzano diversi substrati enzimatici
per la rivelazione.
Il substrato per la rivelazione chemiluminescente di anticorpi HRP, descritto
per applicazioni in micropiastra, permette una veloce e sensibilissima
rivelazione di anticorpi e sonde HRP immobilizzate su membrana. Con questo
substrato, i blot possono essere esposti ai raggi X o a pellicole Polaroid ad
alta velocità per una registrazione permanente dei risultati (10).
Kit e substrati per immunostaining
In commercio è presente una serie di substrati per la visualizzazione in
microscopia ottica di molecole reporter marcate in genere con gli enzimi AP e
HRP. La varietà di colori disponibili permette la localizzazione di
molteplici antigeni. I reagenti sono forniti come prodotti separati o come
parte di kit completi.
I substrati di anticorpi o streptavidina marcati con HRP sono l'AEC
(amino-ethyl-carbazole) che fornisce una colorazione rossa, e il DAB (diaminobenzidine)
che produce un precipitato marrone al sito antigenico.
Per l'immunostaining di anticorpi /streptavidina marcati con AP si usa spesso
il fast Red. Alcuni di tali substrati (ad esempio il DAB) sono adatti anche per
saggi di immunoblotting come Wastern e dot blots.
Citiamo la disponibilità sul mercato una serie di kit per immunostaining
caratterizzati da un sistema di rivelazione strptavidina-biotina universale,
contenente cioé una speciale formulazione di anticorpi secondari biotinilati
che permette di utilizzare anticorpi primari provenienti da animali immunizzati
di diverse specie utilizzando un solo anticorpo secondario e un solo kit (.
11)
Stoccaggio degli anticorpi
Gli anticorpi possono essere liofilizzati o in forma liquida.
I prodotti liofilizzati devono essere stoccati a 2-
Per gli anticorpi commercializzati in forma liquida vale lo stesso discorso
degli anticorpi liofilizzati una volta ricostituiti Nel caso che gli anticorpi
siano coniugati (a enzimi, fluorocromi, biotina), per una conservazione a lungo
termine a
Fattori di crescita, citochine, recettori e realtivi anticorpi
Fattori di crescita, citochine, recettori e i loro anticorpi purificati sono
diventati degli strumenti fondamentaleper l'analisi delle strutture e delle
funzioni cellulari di queste molecole di grande importanza biologica. I fattori
di crescita sono stati purificati di una grande varietà di fonti. Tradizionalmente,
i tessuti e le secrezioni animali rappresntano la sorgente principale di
fattori di crescita. Tuttavia, molti di questi vengono ora prodotti per via
sintetica o grazie alla tecnologia del DNA ricombinante. Tra i prodotti
presenti in commercio per l'uso nella ricerca sui recettori e negli studi
cellulsari rientrano fattori di crescita purificati, anticorpi mono e
policlonali contro i fattori di crescita e i loro recettori, recettori solubili
e kit ELISA.
Servizi custom immunologici
I servizi custom di tipo immunologico che parecchie società propongono
ai ricercatori riguardano la produzione di anticorpi policlonali (con
protocolli adattati alle specifiche richieste del cliente), la generazione di
ibridomi e lo scale-up della produzione di anticorpi monoclonali in asciti.
Viene spesso offerta assistenza anche per quanto concerne la purificazione, la
caratterizzazione, la frammentazione e la coniugazione degli anticorpi voluti.
La coniugazione può essere quella tra anticorpo e molecola reporter (enzima,
fluorocromo, oro ecc.) oppure tra aptene e carrier , per rendere più
immunogenici piccoli antigeni (apteni) che non sono in grado di far partire una
risposta immunitaria adeguata, graie alla coniugazione di questi con grosse
molecole carrier come ad esempio la siero albumina bovina (BSA).
Anticorpi in forma liquida confezionati e pronti per la
vendita da parte delle aziende produttrici e distributrici
(BioSPA - HyCult Biotechnology).
. 1 - Schema della struttura di una molecola di anticorpo formata da due catene pesanti(H) identiche e da due catene leggere (L) pure identiche. I siti di legame per l'antigene sono formate da un complesso delle regioni N-terminali di entrambe le catene L e H.
I linfociti di un animale immunizzato sono mescolati con una
linea di cellule di mieloma (cellule B tumorali) in presenza di un reagente
fusogenico, in genere polietilen glicol (PEG).
Si scelgono linee cellulari di mieloma che non secernono anticorpi in modo che
venga prodotta una singola specie di anticorpo, che è quella prodotta
dalla cellula B normale (non tumorale). La cellula ibrida (ibridoma) eredita la
specificità antigenica dalla cellula B normale e l'immortalità
dalla cellula tumorale. Le cellule B normali non fuse non sono immortali e
muoiono in coltura. Le linee cellulari mielomatose utilizzate sono mutanti
selezionati per l'assenza degli enzimi ipoxantina guanina fosforibosil
trasferasi (HGPRT) e timidina kinasi (TK) e sono incapaci di utilizzare i
pathway di salvataggio della sintesi di acidi nucleici. Quindi, il mieloma
mutante muore se viene bloccata la via principale per la sintesi di purine e
pirimidine, utilizzando l'analago dell'acido folico aminopterina, dato che
nessuno dei due pathway è disponibile.L'ibridoma eredita i geni del
pathway di salvataggio dalla cellula B normale ed è quindi in grado di
utilizzare ipoxantina e timidina, sopravvivendo in tal modo in un terreno HAT
(hypoxanthine, aminopterin, thymidine). Le cellule di un ibridoma possono poi
essere clonate diluendole a meno di 1 cellula/pozzetto in piastre da 96
contenenti feeder: le cellule che cresceranno in un singolo pozzetto saranno
identiche perché derivate da un'unica cellula. Nel supernatante del clone
ottenuto si troveranno gli anticorpi monoclonali secreti.
. 2 - Uso di papaina, pepsina e ficina immobilizzate oer la frammentazione delle IgG (Prodotti Gianni - Pierce)
. 3 - Immunoprecipitazione di CDK4, CDK6 e p16 marcate con
35S utilizzando anticorpi anti-Ciclo cellulare (Genzyme - Clontech ).
Le cellule IMR90 che esprimono le oncoproteine E6 ed E7 di papilloma virud di
tipo 16 sono state marcate metabolicamente con metionina 35Se immunoprecipitate
con anticorpi anti-CD4, CDè e p16, con o senza pre-incubazione con il
peptide antigenico competitivo (pep), e risolte su SDS-PAGE.
Si può notare che i peptidi di controllo CD4 e CD6 sono in grado di
inibire completamente la coimmunoprecipitazione.
peptidi antigenici
. 4 - Esempio di staining immuno-fluorescente di cellule di
glioblastoma di ratto C6.
La fluorescenza rossa mostra i filamenti di vimentina usando MAb
anti-vimentina. La fluorescenza blu è il nucluo sottoposto a co-staining
con DAPI (Sigma).
. 5 - Cellule enterocromaffini (EC) immunoreattive per 5HT
(serotonina) nell'intestino di topo dopo immunostaining con il kit pronto
all'uso BIOSPA immunoperossidasi (in alto) e immunofosafatsi (in basso).
Il kit amplifica il segnale di marcature realizzate con anticorpi primari,
tramite anticorpi secondari biotinilati e un sistema stabile di rivelazione con
perossidasi o fosfatasi alcalina.
genzyme
Nuovi anticorpi da Genzyme, Clontech e Oncogene R.P.
Genzyme srl mette a disposizione dei ricercatori un pannello
completo di reagenti per lo studio della risposta Th1/Th2. I prodotti comprendono
anticorpi monoclonali e policlonali con svariate applicazioni comprendenti:
FACS, Neutralizzazione, Western Blot e sistemi ELISA.
Tra i sistemi ELISA, oltre ai kit tradizionali a 96 pozzetti con piastra
coattata con anticorpo di cattura, è disponibile anche il DuoSet. Questo
sistema contiene due anticorpi (Ab) ottimizzati per il funzionamento in Elisa,
standard, piastre, reagenti di rivelazione e protocollo dettagliato.
Poiché le citochine sono coinvolte anche nel processo di apoptosi, Genzyme propone
per questo studio fattori neurotrofici e Ab monoclonali/ policlonali contro i
recettori del TNF (recettore I e II) e contro l'IL-l2. Tra le novità
più recenti sono da annoverare le chemochine: human ENA -78 e human
GRO-a/MGSA e anticorpi contro CD54, CD62L, CD62E e TSP1.
Genzyme srl informa che CLONTECH ha introdotto a luglio un ampio numero di
nuovi Ab (cicline, chinasi-ciclina dipendenti e inibitori della chinasi-ciclina
dipendenti) per lo studio del ciclo cellulare. Questi Ab sonovenduti con il rispettivo
peptide di controllo e con un lisato cellulare come controllo positivo.
Genzyme segnala inoltre una interessante camna promozionale (scadenza
Dicembre '97) sugli anticorpi Oncogene Research Product per l'indagine del
ciclo cellulare: acquistando 2 anticorpi si ha diritto ad averne un terzo in
omaggio.
italscientifica
IMMUNON SHANDON-LIPSHAW
. 6 - Schema dell'adsorbimento degli anticorpi a una particella di oro colloidale (Inalco - British BioCell International).
celbio
Reagenti per la ricerca immunologica KPL e Cedarlane
celbio rappresenta in Italia due società che hanno una
lunga tradizione in campo immunologico: la canadese Cedarlane e la statunitense
KPL.
Cedarlane offre un'ampia gamma di anticorpi primari e proteine ricombinanti
prodotti in topo, ratto o uomo, antisieri HLA, complemento, anticorpi secondari
e coniugati di streptavidina, oltre a una serie di prodotti e immunocolonne per
la separazione cellulare.Tra questi ultimi, sono particolarmente innovativi i
prodotti Lympholyte per la separazione delle cellule mediante centrifugazione
con lo scopo di isolare linfociti vitali da popolazioni di cellule di topo,
ratto, coniglio e uomo. Le applicazioni di Lympholyte includono l'isolamento di
linfociti vitali da sangue periferico oppure da organi linfoidi (soprattutto
dalla milza) e la rimozione delle cellule morte dalle sospensioni di linfociti.
Tra i prodotti KPL disponibili in catalogo rientrano: anticorpi purificati per
affinità, marcati e non, substrati stabili, soluzioni e diluenti.,
immunoreagenti come proteina A e streptavidina marcate
KPL offre anche una serie di servizi specializzati come:
- produzione di anticorpi(mono e policlonali) in capra, coniglio, pollo, pesce,
topo,
- purificazione e coniugazione su richiesta del cliente (attacco di enzimi e
fluorocromi ad anticorpi e di proteine carrier ad apteni)
- sviluppo di saggi utilizzando saggi del cliente o commerciali, tra cui ELISA
in micropiastra, blotting su membrana, saggi immunoistochimici
Tra i sistemi di rivelazione enzimatica citiamo il LumiGLO, un substrato
chemiluminescente a base di luminolo per la rapida rivelazione di sonde o
anticorpi marcati con HRP in piastre microtiter o immobilizzati su membrana.
Con il substrato LumiGLO, che fornisce una maggiore sensibilità di
quella offerta dagli anticorpi marcati con 125I o dai substrati colorimetrici,
i blot possono essere esposti ai raggi X o a pellicole Polaroid ad alta
velocità per una registrazione permanente dei risultati
. 7 - Nuovo reagente di purificazione/separazione di
anticorpi CBD-proteina A (Sigma).
Il Il Cellulose Binding Domain (CBD) è stato geneticamente legato alla
proteina A ricombinante in modo da creare un ligando bivalente, la proteina di
fusione CBD-proteina A. Una estremità è capace di legarsi a una
matrice di cellulosa, mentre l'altra estremità lega gli anticorpi. la
proteina di fusione può essere utilizzata per purificare anticorpi
legandoli a beads di cellulosa o membrane di nitrocellulosa .
. 8 - Schema di funzionamento del kit completo per saggi
EIA sandwich su micropiastra per la rivelazione di di HTLV-I, II (Astra -
Immunotech).
Il kit contiene piastre microtitolo rivestite di anticorpo specifico e tutti i
reagenti necessari per completare la reazione: anticorpo secondario
biotinilato, streptavidina coniugata a perossidasi, il substrato TMB con
relativa soluzione stop.
. 9 - Diversi substrati per la rivelazione in
immunoblotting di anticorpi marcati con enzimi (Celbio - KPL).
Si tratta di Western Blots di lisati virali di HIV-l elettroblottati su
membrana di nitrocellulosa. L'immunorivelazione con siero umano positico per
HIV è stat seguita dall'aggiunta di un anticorpo marcato con un enzima e
rivelata con il substrato adatto.
. 10 - HIV Western blot sviluppato utilizzando il substrato chemiluminescente LumiGLO (Celbio - KPL)
. 11 - Esempio di immunostaining con il kit
'universale' OmniTags Plus (Genzyme - Shandon Lipshaw)
Nel caso rafurato, l'immunostaining è stato ottenuto utizzando il
substrato DAB che produce una colorazione marrone facilmente visibile.
Astra
Via Ciro Menotti 1/A
20129 Milano
Tel. 02/745565
Fax 02/747014
Bio-Optica Milano
Via S.Faustino 58
20134 Milano
Tel. 02/2640274
Fax 02/2153000
BioSPA-Soc. Prod. Antibiotici
Via Biella 8
20143 Milano
Tel. 02/891391
Fax 02/8132983
Celbio
Via ino 20/22
20016 Pero (MI)
Tel. 02/381951
Fax 02/38101465
(vedi scheda)
Genzyme
Via Cesare Cantù 11
20092 Cinisello Balsamo (MI)
Tel. 02/6127621
Fax 02/66011923
(vedi scheda)
Histo-Line Laboratories
Viale Montenero 66
20135 Milano
Tel. 02/55012627
Fax 02/55012636
ICN Biomedicals
Via Lambro 23/25
20090 Opera (MI)
Tel. 02/57601041
Fax 02/57601610
Inalco Spa - Div. Labo
Via Calabiana 18
20139 Milano
Tel. 02/55213005
Fax 02/5694518
Italscientifica
Via Assarotti 5/6
16121 Genova
Tel. 010/8318901
Fax 010/8398808
(vedi scheda)
Poiesys
Via T. Aspetti 38
35132 Padova
Tel. 049/8643339
Fax 049/8643441
Prodotti Gianni
Via Quintiliano 30
20138 Milano
Tel. 02/5097746
Fax 02/5097358
Sigma Aldrich
Via Gallarate 154
20151 Milano
Tel. 02/33417730
Fax 02/38010737
Space Import-Export
Via Minturno 9
20127 Milano
Tel. 02/2575377
Fax 02/2572231
The purpose of immunofluorescence is to detect the location and relative abundance of any protein for which you have an antibody. Once you have antibodies to your favorite protein, you can use them to indicate where the protein is located. In this example, we will use antibodies for the calcium ATPase, or pump, that is located in the endoplasmic reticulum (ER) of very cell. The antibody used here only recognized the chicken calcium ATPase but immunofluorescence can be used on any protein.
The key to this entire process is the ability to visualize the antibody when looking through a microscope. Since antibodies are smaller than calcium ATPases, you cannot see the antibody directly. Therefore, you have to use a fluorescent dye that is covalently attached to the antibody. When a light illuminates the fluorescent dye, it absorbs the light an emits a different color light which is visible to the investigator and can be photographed.
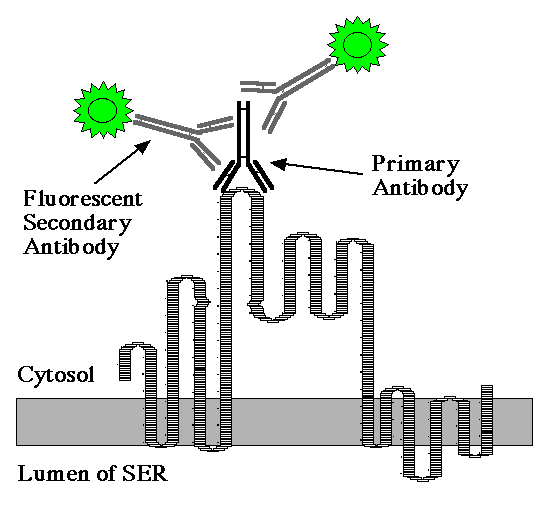
ure
The first step is to choose your cells of interest. In this case, we will look at a chicken fibroblast, or skin cell. It was grown in tissue culture and so it appears as an isolated cell witn no visible neighbors.
The cell was fixed with formaldehyde to retain the shape and location of all cellular proteins. The cell was treated with a mild detergent to disolve small holes in the membranes so the antibodies could have access to the cytoplasm. Because the calcium ATPase is located in the ER, the antibodies must have access to the cytoplasm or they could not bind to the target protein.
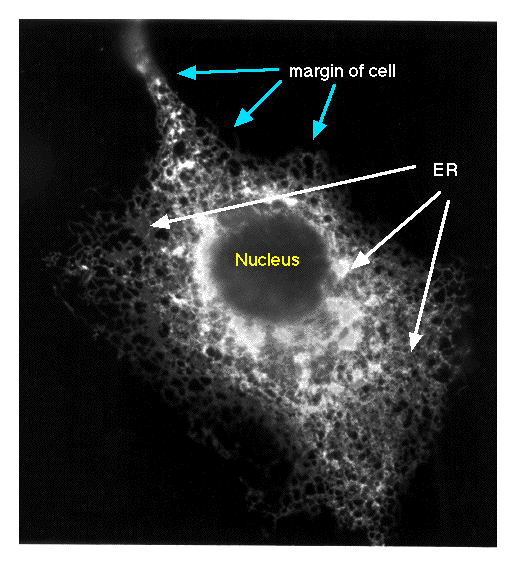
ure 2. This immunofluorescence micrograph shows the ER being labeled with a monoclonal antibody against the the chicken calcium ATPase. This chicken cell was fixed, permeablilized, and processed for immunofluorescence. White indicates the location of the fluorescent antibody and thus the calcium ATPase to which the antibody was bound. Immunofluorescence photomicrograph by A. Malcolm Campbell.
Using immunofluorescence, investigators can see when, where and how much of their favorite protein is expressed in any cell or tissue. On this web e, you can see other examples where the same antibody was used to labled chicken calcium ATPase in other chicken tissues.
Antibodies are an important tool for demonstrating both the presence and the subcellular localization of an antigen. Cell staining is a very versatile technique and, if the antigen is highly localized, can detect as few as a thousand antigen molecules in a cell. In some circumstances, cell staining may also be used to determine the approximate concentration of an antigen, especially by an image analyzer. Cell staining can be divided into four steps: cell preparation, fixation, application of antibody, and evaluation.
As a first step, cells to be stained are attached to a solid support to allow easy handling in subsequent procedures. This can be achieved by several methods: adherent cells may be grown on microscope slides, coverslips, or an optically suitable plastic support. Suspension cells can be centrifuged onto glass slides, bound to solid support using chemical linkers, or in some cases handled in suspension.
The second step is to fix and permeabilize the cells, to ensure free access of the antibody to its antigen. Perfect fixation would immobilize the antigens, while retaining authentic cellular and subcellular architecture and permitting unhindered access of antibodies to all cells and subcellular tments. Wide ranges of fixatives are commonly used, and the correct choice of method will depend on the nature of the antigen being examined and on the properties of the antibody used. Fixation methods fall generally into two classes: organic solvents and cross-linking reagents. Organic solvents such as alcohols and acetone remove lipids and dehydrate the cells, while precipitating the proteins on the cellular architecture. Cross-linking reagents (such as paraformaldehyde) form intermolecular bridges, normally through free amino groups, thus creating a network of linked antigens. Cross-linkers preserve cell structure better than organic solvents, but may reduce the antigenicity of some cell components, and require the addition of a permeabilization step, to allow access of the antibody to the specimen. Fixation with both methods may denature protein antigens, and for this reason, antibodies prepared against denatured proteins may be more useful for cell staining. Four different fixation methods are described. The appropriate fixation method should be chosen according to the relevant application.
The third step of cell staining involves incubation of cell preparations with antibody. Unbound antibody is removed by washing, and the bound antibody is detected either directly (if the primary antibody is labeled) or, indirectly using a fluorochrome-labeled secondary reagent. (See Fluorescent Dye Properties)
In the fourth and final step, the staining is evaluated using fluorescence microscopy.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta