| chimica |
|
CAMBIAMENTI DI STATO ED EQUILIBRIO DINAMICO.
Un cambiamento di stato avviene quando una sostanza viene trasformata da uno stato fisico a un altro. I possibili cambiamenti di stato sono sintetizzati nella ura seguente.
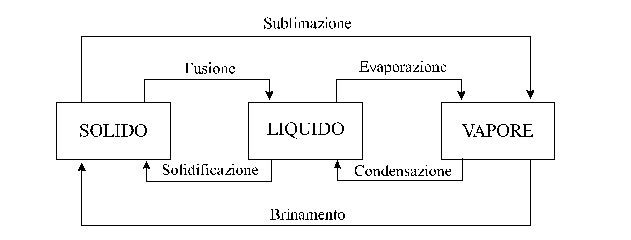
Una delle cose più interessanti dei cambiamenti di stato è che a una particolare temperatura essi tendono a raggiungere una condizione chiamata equilibrio dinamico.
Energetica delle trasformazioni di fase
I sistemi che saranno esaminati sono costituiti da materiali puri che possono subire trasformazioni in solido, liquido, gas e viceversa, mediante appropriata modificazione dell'ambiente circostante.
La quantità di calore assorbito nell'evaporazione di una mole di liquido è molto importante, poiché è una misura dell'energia potenziale intermolecolare. Un modo di descrivere questo processo energetico, che ha il vantaggio di sottolineare la trasformazione che si verifica nel sistema, è quello di utilizzare la funzione di stato entalpia. La quantità di calore assorbita da sistema in ogni trasformazione a pressione costante è chiamata variazione di entalpia del sistema ed è simbolizzata da DH. Se un sistema assorbe calore, la sua entalpia aumenta e DH è un numero positivo; se il sistema sviluppa calore, la sua entalpia diminuisce e DH è un numero negativo; così l'entalpia può essere pensata come una specie di contenuto di calore del sistema.
Nel processo di sublimazione è necessario fornire calore al sistema per vincere le forze attrattive tra le molecole nello stato solido; la quantità di calore assorbita dal sistema se una mole di solido sublima è nota come entalpia di sublimazione, DHsub.
In stretto rapporto con le entalpie di sublimazione e di vaporizzazione è l'entalpia di fusione, calore assorbito quando una mole di solido si trasforma in liquido a pressione costante
Si noti che la trasformazione diretta solido-vapore è equivalente alla fusione del solido seguita dall'evaporazione del liquido. Poiché le condizioni finali ed iniziali del sistema sono le stesse, i valori di DH per i due processi devono essere uguali, cioè:
![]()
Per una data sostanza, DHfus è sempre molto minore di DHvap. Si è notato, infatti, che in un liquido le molecole sono impacchettate più liberamente che in un solido. Questa piccola diminuzione della densità attenuta l'effetto delle forze di attrazione tra le molecole; di conseguenza è necessaria una quantità relativamente piccola di energia per trasformare un solido in liquido. L'evaporazione di un liquido separa completamente le molecole riducendo così a zero le forze d'attrazione tra di esse. L'evaporazione produce un mutamento ben più profondo della fusione nell'intorno molecolare, e di conseguenza DHvap è più elevato di DHfus.
Equilibrio solido-liquido (fusione e solidificazione)
Consideriamo la trasformazione di una sostanza dallo stato solido S allo stato liquido L
![]()
Lo stato liquido può esistere in un numero di conurazioni maggiori che lo stato solido, in quanto le particelle possono occupare posizioni diverse le une rispetto alle altre. Ne segue che lo stato liquido ha una probabilità di esistenza maggiore dello stato solido e quindi è più disordinato. La trasformazione, avvenendo con un aumento di entropia (DS=SL-SS>0), dovrebbe essere spontanea. D'altra parte la trasformazione di una sostanza dallo stato liquido allo stato solido
![]()
avvenendo con diminuzione di entalpia (DH=HS-HL<0), dovrebbe anch'essa essere spontanea.
Per stabilire verso quale stato il sistema evolverà spontaneamente, definiamo la funzione Energia libera G tale che si abbia:
![]()
Poiché una trasformazione che avviene con diminuzione di entalpia DH<0 e con aumento di disordine DS>0 è comunque spontanea, dalla relazione scritta si ricava che a temperatura costante per una trasformazione spontanea deve essere
![]()
Dalla definizione di energia libera si vede che esiste una sola temperatura al di sopra della quale DG>0 e al di sotto della quale DG<0, se consideriamo trascurabili le variazioni di DH e DS sia durante la trasformazione sia con la temperatura. Definiamo tale temperatura, temperatura di fusione Tf, alla quale sarà
![]()
A questa temperatura il solido ed il liquido coesistono poiché la tendenza del sistema ad evolvere verso lo stato di minore entalpia (solido) è perfettamente bilanciata dalla tendenza del sistema ad evolvere verso lo stato più disordinato (liquido) ossia
![]()
e diremo che il sistema è in equilibrio dinamico. Cioè la velocità con cui particelle di solido passano allo stato liquido è uguale a quella con cui particelle di liquido passano allo stato solido.
Poiché le variazioni di entropia connesse con la trasformazione solido-liquido sono dello stesso ordine di grandezza per tutte le sostanze, le sostanze con calore di fusione elevato avranno anche temperatura di fusione elevate (ciò lo capiremo meglio a proposito delle curve di riscaldamento).
Tenuto conto che il passaggio di stato solido-liquido avviene a temperatura costante (DEc=0), si ottiene
![]()
e poiché per quasi tutte le sostanze il liquido ha densità minore del solido dL<ds, un aumento di pressione sul sistema comporta un aumento della temperatura di fusione Tf (DV>0).
Per l'acqua, invece, è dL>ds, DV<0, e quindi un aumento della pressione comporta una diminuzione di Tf. Comunque poiché la variazione di volume DV è molto piccola in tutti i casi (le densità dei liquidi differiscono poco da quelle dei rispettivi solidi) a grandi variazioni di pressione, corrispondono sempre piccole variazioni di temperatura di fusione.
Equilibrio liquido-vapore (evaporazione e condensazione)
|
|
Consideriamo un recipiente contenente una sostanza molecolare allo stato liquido, si osserva che se il recipiente è lasciato aperto il livello del liquido si abbassa progressivamente nel tempo. Ciò è dovuto alla trasformazione spontanea del liquido in vapore che si disperde nell'ambiente esterno. La variazione di energia libera connessa con questa trasformazione è
![]()
La variazione di entropia DSv è, in questo caso, molto grande perché non c'è limite per il volume occupato dal vapore (DS ¥). Ne segue che, malgrado il fenomeno sia endotermico, cioè avvenga con DH>0, la variazione di energia libera sarà minore di zero ad ogni temperatura e resterà tale fino alla completa evaporazione del liquido. Dunque se il recipiente che contiene il liquido è aperto, l'unica trasformazione possibile è liquido vapore (non è possibile la trasformazione inversa) qualunque sia T. Al variare di T varierà solo la velocità di evaporazione.
La velocità v con cui il liquido
evapora è proporzionale al numero di molecole che urtano la superficie
libera del liquido con energia cinetica maggiore dell'energia DHv
necessaria a rompere i legami fra le molecole nel liquido. Il numero di
molecole per unità di superficie che urtano la superficie libera del
liquido nell'unità di tempo è proporzionale alla concentrazione
molare, cioè al rapporto ![]() , dove nl
è il numero di molecole di liquido e V* il volume nel quale si possono
muovere, e alla componente lungo l'asse z della velocità media delle
molecole
, dove nl
è il numero di molecole di liquido e V* il volume nel quale si possono
muovere, e alla componente lungo l'asse z della velocità media delle
molecole ![]() . Poiché
anche nei liquidi, come nei gas, esiste una distribuzione di energia cinetica
fra le molecole, il numero di molecole che possiede energia cinetica maggiore
del valore DHV è esprimibile come
. Poiché
anche nei liquidi, come nei gas, esiste una distribuzione di energia cinetica
fra le molecole, il numero di molecole che possiede energia cinetica maggiore
del valore DHV è esprimibile come
![]()
In definitiva si avrà che la velocità di evaporazione è data da
![]()
Si vede come un liquido evapora tanto più rapidamente:
a) quanto più piccolo è il DHv (liquido più volatile), cioè quanto più sono deboli le forze di attrazione intermolecolari;
b) quanto più grande è la superficie superiore A del liquido.
Poiché evaporano le molecole che hanno energia cinetica superiore al DHV, le molecole che restano nel recipiente si trovano mediamente ad un livello energetico più basso, cioè il liquido tenderebbe a raffreddarsi se non potesse assorbire calore dall'esterno.
Infatti per il principio di conservazione dell'energia si ha:
![]()
quindi se il recipiente che contiene il liquido è isolato termicamente dall'ambiente esterno (Q=0), all'aumento di energia necessario all'evaporazione (DEp + P DV>0) corrisponde una diminuzione di energia cinetica delle molecole (DEc<0) ed il liquido si raffredda: pertanto la velocità di evaporazione diminuisce.
Il liquido per evaporare a temperatura costante (DEc=0), deve assorbire dall'ambiente esterno una quantità di calore Q pari all'aumento dell'energia potenziale (DEp>0) dovuto all'allontanamento delle molecole ed al lavoro contro la pressione esterna dovuto all'aumento di volume del sistema (P DV>0). Alcuni liquidi molto volatili, come il cloruro di etile, durante l'evaporazione possono dare una sensazione di freddo alla pelle e sono utilizzati come anestetici locali.
|
|
Consideriamo ora lo stesso liquido posto in un recipiente ermeticamente chiuso e mantenuto a temperatura costante T, sul manometro M1 si legge una pressione che aumenta nel tempo sino a raggiungere un valore che non varia se la temperatura rimane costante.
La pressione registrata dal manometro è dovuta agli urti delle molecole che evaporano dal liquido con velocità ve che, essendo T = costante, è costante nel tempo. Le molecole di vapore, poiché hanno a disposizione un volume limitato, urtano contro le pareti del recipiente e contro la superficie del liquido.
Tutte quelle che urtano contro la superficie del liquido, a causa delle
forze di attrazione delle molecole superficiali, condensano. La velocità di condensazione vc
dipende dal numero di urti nell'unità di tempo per unità di
superficie. Essendo il numero di urti proporzionale alla concentrazione di
molecole nel vapore cV, e alla componente lungo l'asse z della
velocità media delle molecole ![]() , in
definitiva si ha:
, in
definitiva si ha:
![]()
|
|
La concentrazione cV delle molecole nel vapore cresce nel tempo a partire da un valore zero, per cui la velocità di condensazione aumenta nel tempo. Aumentando la velocità di condensazione, essa diventa uguale alla velocità di evaporazione. In questo momento, il numero di molecole che entrano e che lasciano la fase vapore per unità di tempo è lo stesso: la concentrazione delle molecole nel vapore non può ulteriormente aumentare e di conseguenza la pressione del vapore cessa di aumentare e rimane costante (il vapore si dice saturo). Se il sistema viene lasciato indisturbato a temperatura costante, l'evaporazione e la condensazione continuano con uguali velocità e la pressione del vapore rimane immutata. Si tratta, quindi, di una situazione di equilibrio tra le due fasi. Si noti in particolare che, all'equilibrio l'evaporazione e la condensazione non cessano, ma la costanza della pressione di vapore di equilibrio è una conseguenza di questi processi opposti che procedono a uguali velocità. Si dice quindi che l'equilibrio di fase ha natura dinamica.
Il volume a disposizione di ciascuna molecola diminuisce al crescere del numero di molecole di vapore, la variazione di entropia DSV, quindi, nel tempo diventa sempre più piccola. Ne segue che il prodotto T DSV, ad un certo istante, diventa uguale a DHV e il sistema è in equilibrio dinamico
![]()
Se la temperatura del sistema e/o il volume a disposizione del vapore aumentano, il termine T DSv aumenta, superando il termine DHv. Si avrà di nuovo DGv<0 ed un'ulteriore quantità di liquido passa allo stato vapore con conseguente diminuzione di DSv. Quando il T DSv diventa uguale al DHv si ripristinano le condizioni di equilibrio dinamico DGv=0. Se viceversa la temperatura e/o il volume del vapore diminuiscono, per ripristinare le condizioni di equilibrio altro vapore deve condensare.
Quando il sistema ha raggiunto le condizioni di equilibrio
![]()
la pressione segnata dal manometro non varia ulteriormente e prende il nome di pressione di vapore saturo o tensione di vapore pl°. In particolare eguagliando le espressioni delle due velocità (di evaporazione e di condensazione) ed assumendo che il vapore si comporti idealmente, si ha:
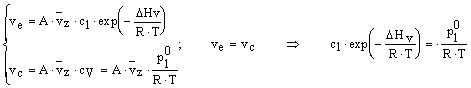
![]()
in cui la concentrazione del liquido cl non varia al variare della quantità di sostanza che è evaporata.
|
|
Dall'espressione trovata per la tensione di vapore si vede come essa varia con la temperatura in maniera esponenziale. Poiché a temperature superiori alla temperatura critica TC non può esistere lo stato liquido, per temperature T>TC non può esistere l'equilibrio dinamico liquido vapore. La funzione pl° = f(T) ha quindi significato solo per temperature minori di TC. Per temperature T>TC la pressione P segnata dal manometro aumenta con la temperatura, ma secondo le leggi dello stato gassoso (P V = n R T).
è inoltre importante osservare la dipendenza della pressione di vapore dal volume. Si supponga a tal fine che il sistema liquido-vapore sia all'equilibrio in un cilindro chiuso da un pistone mobile. Cosa avverrà se si innalza improvvisamente il pistone e si aumenta leggermente il volume del cilindro mantenendo costante la temperatura del sistema?. Come effetto immediato si ha diminuzione della pressione del vapore e il sistema non è più all'equilibrio. Poiché vi sono meno molecole di vapore per unità di volume, il numero degli urti per unità di tempo con la superficie del liquido è inferiore e diminuisce la velocità di condensazione. Tuttavia la velocità di evaporazione non cambia, poiché l'espansione non altera in nessun modo lo stato del liquido. Così, come conseguenza della perturbazione si ha che la velocità di evaporazione ancora una volta è maggiore di quella di condensazione; condizione che provocherà inevitabilmente un aumento del numero delle molecole nel vapore, una conseguente eguaglianza tra velocità di condensazione e di evaporazione ed il ripristino dell'equilibrio di fase.
Si sottoponga ora il sistema, inizialmente all'equilibrio, a una improvvisa diminuzione di volume. Questo comporta un aumento di concentrazione delle molecole del vapore ed un conseguente aumento della velocità di condensazione. Ancora una volta, la velocità di evaporazione rimane invariata. Se la velocità di condensazione è maggiore di quella di evaporazione, il numero di molecole di vapore diminuisce fino a che la velocità dei processi opposti si uguagliano e l'equilibrio viene ripristinato. Così, indipendentemente dalla direzione in cui si sposta il sistema, esso ritorna da solo allo stato di equilibrio.
Si noti in particolare che, all'equilibrio, la pressione del vapore è data dall'eguaglianza delle velocità di condensazione e di evaporazione e che la velocità di evaporazione, determinata soltanto dalla frazione di molecole che hanno energia sufficiente ad abbandonare il liquido, è sempre costante a temperatura costante. Pertanto, ad una certa temperatura, la pressione di vapore di equilibrio è sempre la stessa, indipendentemente dalla direzione seguita dal sistema per raggiungere l'equilibrio stesso; quindi la pressione di vapore è indipendente dal volume.
In realtà tale affermazione va presa con molta cautela, nel senso che la pressione di vapore è sì indipendente dal volume, tuttavia ciò è vero sempre che il volume sia compreso entro limiti di variazione ben determinati: il limite inferiore di variazione del volume è fornito dalla compressibilità del liquido; il limite superiore è dato dalla rarefazione del vapore.
Equilibrio solido-vapore (sublimazione e brinamento)
|
|
Consideriamo la trasformazione di una sostanza dallo stato solido S allo stato di vapore V
![]()
la variazione di energia libera DGs connessa con questa trasformazione è
![]()
La variazione di entropia DSs è, in questo caso, ancora maggiore che nel caso dell'evaporazione, in quanto lo stato iniziale è più ordinato. Ne segue che, nonostante la trasformazione avvenga con un aumento di entalpia (DHsub=DHfus+DHvap) maggiore che nel caso dell'evaporazione, la variazione di energia libera è, in questo caso, minore di zero ad ogni temperatura e resterà tale fino alla ssa del solido.
Le molecole di un solido vibrano intorno alle loro posizioni fisse del reticolo cristallino. Poiché l'energia termica è distribuita secondo la distribuzione di Boltzmann sulla superficie del solido, alcune molecole vibrano con energia superiore a quella necessaria DHS a rompere i legami e passare allo stato di vapore.
Se la sublimazione avviene in un recipiente ermeticamente chiuso contenente una sostanza allo stato solido, come nel caso dell'evaporazione, dopo un certo tempo la velocità di brinamento diventa uguale a quella di sublimazione e il sistema raggiunge una condizione di equilibrio dinamico.
|
|
La pressione del vapore pS° (segnata dal manometro M2) in queste condizioni, rappresenta la tensione di vapore del solido e cresce con la temperatura secondo la relazione:
![]()
In particolare si osserva che, essendo DHs>DHv, la pendenza della curva di variazione di pS° con la temperatura è maggiore nel caso di un solido rispetto a quella relativa ad un liquido.
Equilibrio solido-liquido-vapore: il punto triplo
Studiando gli equilibri liquido-vapore e solido-vapore, si è visto che le sostanze sia nello stato liquido sia nello stato solido sono dotate di una pressione di vapore caratteristica, la quale dipende fortemente dalla temperatura: al crescere della temperatura aumenta la pressione di vapore.
In particolare si osserva che la pressione del vapore di un solido cresce più rapidamente della pressione del vapore di un liquido, con l'aumentare della temperatura. Ciò è dovuto al fatto che il solido presenta un calore latente di vaporizzazione più elevato. Difatti:
![]()
Pertanto, se riportiamo in uno stesso diagramma la dipendenza dalla temperatura della tensione di vapore delle due fasi condensate (fase liquida e fase solida) di una stessa sostanza, otteniamo un grafico del tipo rappresentato nella ura seguente, in cui si osserva come le due curve si intersecano in un punto.
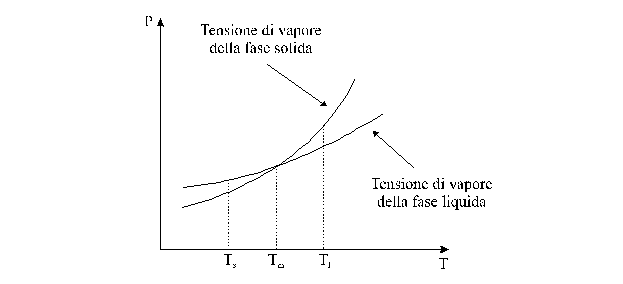
Alla temperatura Tm, corrispondente al punto di incrocio, detto punto triplo, le fasi liquida e solida sono all'equilibrio ed hanno la stessa pressione di vapore.
Non è difficile dimostrare che in queste condizioni liquido e solido devono essere in equilibrio tra di loro. A tal fine si consideri l'apparecchio di ura
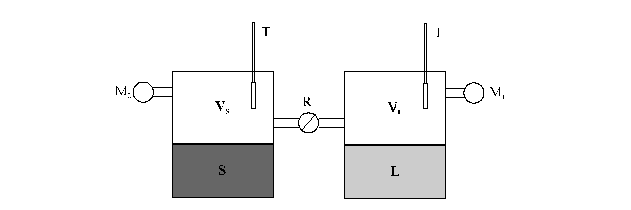
Un recipiente contiene un solido, l'altro il suo liquido, collegati tra loro in modo che attraverso l'apertura di un rubinetto il vapore possa passare liberamente da uno all'altro.
A) Poniamo i due recipienti ad una temperatura Ts<Tm. A tale temperatura il manometro M1 segna una pressione pl° maggiore di quella segnata dal manometro M2. Se si apre il rubinetto R, ci sarà un flusso di vapore dal recipiente di destra a quello di sinistra. La pressione esercitata dal vapore sul solido è più grande di quella di equilibrio, quindi il numero di molecole che si legano alla superficie del solido nell'unità di tempo è più grande di quello che la abbandona: il solido aumenta di proporzione. Sul lato destro la situazione è inversa: la velocità di evaporazione è più grande di quella di condensazione, essendo diminuita la concentrazione del vapore, e il liquido diminuisce di proporzioni. Continuando tale passaggio, il liquido evapora e il vapore si condensa come solido, fino a che tutto il liquido è evaporato e i due manometri segnano la stessa pressione ps° di vapore del solido a Ts.
B) Se poniamo i due recipienti a temperatura Tl>Tm e apriamo il rubinetto R, poiché a questa temperatura ps°>pl°, tutto il solido si trasforma nel liquido e i manometri segnano la pressione pl° tensione di vapore del liquido.
C) È chiaro che solido e liquido non sono all'equilibrio tra loro alle temperature Ts e Tl, poiché se fossero all'equilibrio, il sistema non cambierebbe e le due fasi rimarrebbero invariate. Se l'apparecchiatura è portata alla temperatura Tm, alla quale liquido e solido abbiano la stessa pressione di vapore, essendo la pressione uniforme, non vi è tendenza al passaggio del vapore da uno all'altro recipiente. Così le due fasi rimangono invariate. Il permanere dello stato del sistema indica che le fasi solida e liquida sono in equilibrio ad una temperatura a cui la loro pressione di vapore è la stessa.
Questa situazione rappresenta un caso particolare di un importante principio generale: se ognuna delle due fasi è in contemporaneo equilibrio con una terza, le due fasi sono in equilibrio tra loro.
La temperatura Tm a cui liquido, solido e vapore sono simultaneamente in equilibrio è detta temperatura del punto triplo. Il punto triplo generalmente è molto vicino al punto di congelamento, che è la temperatura alla quale liquido, vapore e solido si trovano simultaneamente in equilibrio, in presenza di aria, ossia alla pressione di 1 atm. Per esempio, l'acqua liquida e il ghiaccio si trovano simultaneamente in equilibrio col vapore d'acqua soltanto alla temperatura di 0°C, in presenza di aria ed alla pressione di 1 atm. Quando l'aria è completamente eliminata da recipiente, acqua, ghiaccio e vapore acqueo si trovano contemporaneamente all'equilibrio soltanto alla temperatura di 0,0098°C. Questa temperatura è chiamata punto triplo dell'acqua e differisce solo di poco dal punto normale di congelamento.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta