| chimica |
|
|||||
|
 La cinetica chimica è lo studio della velocità con la
quale si svolgono le reazioni chimiche.
La cinetica chimica è lo studio della velocità con la
quale si svolgono le reazioni chimiche.
Il concetto di velocità in chimica è lo stesso di tutte le altre branche della scienza, ossia la variazione di una proprietà rispetto al tempo. La velocità in chimica però è intesa come velocità di reazione. La velocità dipende dalla concentrazione dei reagenti, dalla temperatura e dai catalizzatori, che servono ad accelerare o decelerare la reazione.
Con velocità di reazione si intende la variazione di concentrazione di uno dei reagenti o di uno dei prodotti, in rapporto al tempo impiegato. La concentrazione di una sostanza A la indichiamo con
[A]
che esprime la concentrazione di una data sostanza espressa in mol/L. Nello studio della velocità di reazione indicheremo la concentrazione di una data sostanza A con Ca, ossia la concetrazione attuale durante lo svolgersi di una reazione (essa quindi è variabile). Abbiamo anche Ca° che è la concentrazione della sostanza A quando la reazione sta per partire.
L'equazione cinetica, ossia quell'equazione che esprime la velocità di una reazione in funzione delle concentrazioni, è:
V = K Can
Ossia la velocità di una reazione è proporzionale alla concentrazione di una sostenza. In questa equazione K è detta cotante di velocità, Ca è la concentrazione attuale, mentre l'esponente n è detto ordine di reazione, ossia l'esponente che bisogna mettere nella concentrazione attuale Ca nell'equazione cinetica affinché quest'ultima sia d'accordo con i dati sperimentali.
Supponendo di avere due sostanze A e B, e di avere una equazione di 2° ordine
V = K [A][B]
se volessimo abbassare di ordine la sua equazione cinetica, devo adoperare molto B e pochissimo A, in modo che B diventi una costante (ossia [B] rimane pressoché invariata), trasformando quindi l'equazione cinetica in:
V = Kobs [A]
In cui Kobs significa kostante osservata.
Calcolo della velocità di reazione
Si definisce velocità media di reazione V, il rapporto tra la variazione di concentrazione della sostanza e l'intervallo di tempo considerato:
V = ΔCa
Δt
Possiamo così anche definire la velocità istantanea di reazione come la derivata della concentrazione rispetto al tempo presa col segno negativo:
V = - d Ca
d t
Il segno negativo è presente per rendere positiva la velocità, in quanto il segno della concentrazione è negativo perché essa diminuisce.
Supponiamo di avere una reazione di 1° ordine. Per questa reazione la velocità istantanea di reazione e l'equazione cinetica sono:
V = KCa V = - d Ca
d t
Possiamo quindi uguagliare i primi membri, avendo:
KCa = - d Ca - K dt = d Ca
d t Ca
Integrando quest'ultima uguaglianza avremo:
∫ d Ca = -K ∫dt
Ca
Facendo l'integrale definito abbiamo quindi sommato tutte le concentrazioni istante per istante, ottenendo:
lg Ca = -K t + cost
La costante deve essere necessariamente aggiunta, e la possiamo calcolare all'istante t=0, ossia la costante è lg Ca° ( il logaritmo della concentrazione di partenza); abbiamo così:
![]() lg Ca = -K t + lg Ca°
lg Ca = -K t + lg Ca°
![]()
![]() Che corrisponde
all'equazione di una retta y = - mx + c, ossia una retta del tipo: lg Ca
Che corrisponde
all'equazione di una retta y = - mx + c, ossia una retta del tipo: lg Ca
Se la reazione quindi presenta un andamento di questo genere, essa risulta di 1°
Ordine.
Dalla precedente espressione, se portiamo lg Ca° al primo membro, per le proprietà
dei logaritmi possiamo scrivere:
ln Ca = -kt _Ca_ = e-kt
Ca° Ca°
![]() Che ha un grafico del genere:
t
Che ha un grafico del genere:
t

![]()
Ca/Ca° = 1
Il rapporto tra la concentrazione finale e quella iniziale tende
asintoticamente a 0, quindi la reazione non è mai finita.
t
Tempo di dimezzamento di una reazione di 1° ordine
Il tempo di dimezzamento di una sostanza è il tempo necessario affinché la concentrazione iniziale della sostanza si dimezzi; esso di indica con τ o con t ½ . Ricevandolo, dalla precedente espressione avremo:
ln Ca°/2 = - k ln ½ = -k ln 1 - ln 2 = - kτ ln 2 = kτ
Ca°
Da cui :
k
ossia in una reazione di primo ordine il tempo di dimezzamento è indipendente dalla concentrazione iniziale della sostanza.
Consideriamo due sostanza A e B, e consideriamo la concentrazione attuale di A Ca(A) = Ca. Avremo quindi che la velocità di reazione e l'equazione cinetica saranno:
V = KCa² V = - d Ca - d Ca = K Ca² ∫-d Ca = k ∫dt 1/Ca = kt + cost.
dt dt Ca
Anche qui, avendo operato come per le reazioni di 1° ordine, la costante la troviamo ponendo t = 0, avendo così 1/Ca°. L'espressione precedente quindi diventa=
1/Ca = kt + 1/Ca°
![]() che corrisponde
all'equazione generale di una retta y = mx+c. graficamente quindi avremo una
retta di inclinazione positiva:
che corrisponde
all'equazione generale di una retta y = mx+c. graficamente quindi avremo una
retta di inclinazione positiva:

![]()
1/Ca
Anche qui, dall'espressione precedente, il tempo di dimezzamento della
reazione è:
2/Ca° - 1/Ca° = kτ 1/Ca = kτ τ = __1__
kCa°
t
Le reazioni di cui ci interesseremo noi sono le reazioni bimolecolari, ossia quelle reazioni che avvengono per mezzo di urti tra due molecole.
Con reazione elementare intendiamo quella reazione che avviene in un unico atto, ossia esaminiamo solamente l'urto di due particelle che danno luogo ad un prodotto. Le reazioni elementari sono l'unico caso in cui l'ordine di reazione coincide con il coefficiente stechiometrico. Un esempio di reazione elementare ( a temperature maggiori di 500°C) è:
NO2 + CO NO + CO2
La cui velocità di reazione è:
v = k [NO2] [CO]
Vi sono anche le cosiddette reazioni complesse, che procedono attraverso più stadi elementari. Nelle reazioni complesse, ciò che determina il meccanismo della reazione è la reazione lenta.
La temperatura influenza sempre positivamente la velocità di una reazione, ossia all'aumentare della temperatura aumenta anche la velocità di reazione tra due o più sostanze.
Arrhenius scoprì che la temperatura influenza la costante di velocità K; egli quindi scoprì un'equazione detta equazione di Arrhenius:
K = A∙ e - (Ea/Rt)
In cui K è la costante di velocità specifica, A è detto fattore di frequenza o fattore preesponenziale, Ea è l'energia di attivazione, R è la costante dei gas e la t è la temperatura a cui si opera.
L'energia di attivazione e l'equazione di Arrhenius vengono interpretate attraverso due teorie: La teoria degli urti e la teoria dello stato di transizione o delle velocità assolute.
Secondo la teoria delle collisioni, la velocità della reazione dipende dal numero di urti che avvengono, mentre l'energia di attivazione Ea è l'energia minima che devono possedere le molecole dei reagenti affinché urtandosi diamo luogo al prodotto di reazione (ossia a urti elastici).
L'altra teoria, come detto, è quella dello stato di transizione o del complesso attivato.
Secondo l'altra teoria, avendo la seguente reazione tra 3 reagenti A, B e C:
A - B + C AC + B
non può essere che le due reazioni:
A - B A + B A + C AC
siano due eventi separati, ma bisogna ammettere che essi sono interconnessi, cioè man mano che C si avvicina, si allenta il legame tra A e B, dando così luogo alla particella AC. Questa molecola è detta complesso attivato, è instabile e può rompersi per dare di nuovo vita ad AB. Un complesso attivato quindi è una combinazione di due o più molecole che può dar luogo alla formazione dei prodotti oppure scindersi nei reagenti originali; esso si indica con:
[C-----A-----B]
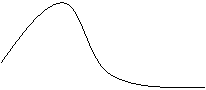
Graficamente quindi avremo:
Esaminiamo ora questo grafico: allo
stato iniziale abbiamo la molecola AB a cui avviciniamo la particella C:
man mano che la avviciniamo, aumenta l'energia potenziale fino a un picco
in cui di ha il complesso attivato. Si ha un
-ΔG, quindi la reazione è isoterma e può avvenire. Ea -ΔG
Ep
![]()
![]()
![]()
![]()
![]()
![]()
[C---A---B]
AB + C AC + B
Coordinata di reazione
Secondo questa teoria quindi l'energia di attivazione è la differenza che c'è tra l'energia potenziale Ep del complesso attivato e l'energia potenziale del sistema reagente
I catalizzatori sono dei composti, inorganici o organici, la cui funzione è quella di far aumentare la velocità di reazione di due o più sostanza, abbassando l'energia di attivazione della reazione. Ciò comporta a livello industriale un maggior rendimento, in quanto l'energia utilizzata è minore.
I catalizzatori però non influiscono nei meccanismi della reazione. Infatti se abbiamo una reazione lenta:
A + B C
Se la faccio avvenire in presenza di catalizzatori:
A + CAT A-----CAT
A-----CAT + B C + CAT
A + B C
Quindi, come si può vedere, è come se il catalizzatore non fosse stato usato, ma se ne guadagna tantissimo in fatto di risparmio di energia e di velocità di reazione.
Non esiste un catalizzatore universale, ossia buono per tutte le reazioni, ma per ogni tipo di reazione ce n'è uno diverso.
Il catalizzatore si dice omogeneo se è nella stessa fase dei reagenti, mentre è detto eterogeneo se esso è in una fase diversa rispetto ai reagenti.
Un particolare tipo di catalizzatori sono quelli organici, detti enzimi.
Essi sono più efficienti dei catalizzatori inorganici; hanno una maggiore selettività (ossia velocizzano solo una determinata reazione e non tutte); infine gli enzimi sono più delicati, ossia si distruggono prima.
Un esempio di enzima è quello presente nella buccia dell'uva, che catalizza il glucosio dell'uva stessa in alcool. Questo però non è un processo infinito, in quanto quando si raggiunge una certa percentuale di alcool, l'enzima viene disattivato dall'alcool stesso.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta