| chimica |
|
Problemi risolti
Si tenga presente che in genere i volumi, a differenza delle masse, non sono additivi. Ad esempio miscelando 20,2 ml (pari a 23 g) di acido solforico al 20% (p/p) con 41,8 ml (pari a 77 g) di soluzione al 98 % (p/p) si ottengono 55,6 ml (pari a 100 g) di soluzione all'80% (p/p) e non 20,2 + 41,8 = 60 ml.
Tuttavia dove non specificato si assuma per semplicità che i soluti abbiano la stessa densità dell'acqua (1 g/ml) e che i volumi siano additivi.
A) Dopo aver disciolto 86,4 g di H2SO4 (densità 1,85 g/ml) in 233,6 g di acqua si ottiene una soluzione di densità 1,198 g/ml. Calcolare la molarità, la molalità, la frazione molare, la percentuale in peso C(p/p), la concentrazione in g/l , la percentuale in volume C(v/v) e la normalità relativa ad una reazione in cui l'acido impegna entrambi gli ioni H+.
calcoliamo la molarità M

calcoliamo la molalità

Calcoliamo la frazione molare

Calcoliamo la percentuale in peso
![]()
Calcoliamo la concentrazione in g/l
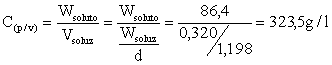
Calcoliamo la percentuale in volume
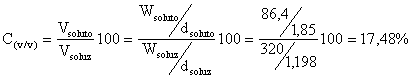
Calcoliamo la normalità
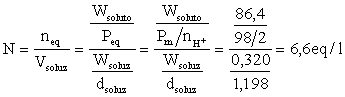
B) Calcolare la molarità e la molalità di una soluzione di acido nitrico contenente il 37,23% (p/p) di acido, sapendo che la sua densità è pari a 1,19 g/ml
100 g di soluzione contengono 37,23 g di acido nitrico e 62,77 g di acqua. 100g di di soluzione corrispondono ad un volume in litri
![]()
37,23 g di acido nitrico corrispondono a
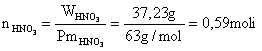
Calcoliamo ora la molarità
![]()
Calcoliamo infine la molalità
![]()
C) Calcolare quanti millilitri di acido solforico concentrato al 98% (p/p) di densità 1,84 g/ml devono essere adoperati per preparare 300 ml di soluzione 2 M.
Calcoliamo quanti grammi di acido solforico sono presenti n 300 ml di soluzione 2 M
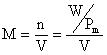 da cui
da cui ![]()
Dobbiamo quindi prelevare una quantità di soluzione concentrata che contenga 58,8 g di acido solforico.
1 ml di soluzione al 98% pesa W = Vd = 1 ml x 1,84 g/ml = 1,84 g
di cui il 98% è acido solforico 1,84 x 0,98 = 1,8 g di acido solforico per ml di soluzione al 98%
Se un millilitro contiene 1,8 g di acido solforico 58,8 grammi saranno contenuti in
![]()
Dovremmo perciò aggiungere ai 32,67 ml di acido solforico al 98% 267,33 ml di acqua per ottenere 300 ml di soluzione 2 M.
C) Avendo a disposizione una soluzione A, 3 M in NaOH ed una soluzione B, 0,2 M in NaOH, calcolare in che proporzione è necessario miscelare le due soluzioni per ottenere una soluzione 0,5 M.
Supponiamo di voler preparare 1 litro di soluzione 0,5 M miscelando VA litri di soluzione 3 M con VB litri di soluzione 0,2 M. Poichè le incognite sono due (VA e VB), sarà necessario scrivere un sistema di due equazioni nelle due incognite.
La prima equazione esprime il fatto che la somma dei due volumi miscelati deve essere pari ad un litro.
VA + VB = 1
La seconda che il numero di moli proveniente dalla soluzione A (nA) e presenti nel volume VA sommate al numero di moli provenienti dalla soluzione B (nB) e presenti nel volume VB deve essere pari a 0,5.
nA + nB = 0,5
ricordando che M = n/V possiamo riscrivere la seconda equazione in funzione dei volumi incogniti
MAVA + MBVB = 0,5
e sostituendo alle molarità (Ma e VA) i rispettivi valori, si ottiene il seguente sistema
![]()
che risolto fornisce i seguenti valori: VA = 0,107 l VB = 0,893 l
Le due soluzioni devono dunque essere miscelate nella seguente proporzione: 10,7% di A e 89,3% di B.
Problemi da risolvere
Quanti grammi di soluto vi sono in:
a) 1 lt di una soluzione 1,5 M di Acido Solforico
b) 5 lt di una soluzione 0,2 M di Perclorato di Sodio
c) 150 cc di una soluzione 3.10-2 M di Bromuro di Argento
Calcolare la molarita', la molalita' e la frazione molare delle seguenti soluzioni
a) 30 gr di Acido Solfidrico in 405 ml di soluzione
b) 2 grammi di Cianuro di Potassio in 252 ml di soluzione
c) 54 grammi di Anidride Perclorica in 1,554 l di soluzione.
Quanti grammi di Idrossido di Bario sono presenti 1,55 litri di una soluzione 2.10-l M.
Quanti grammi di soluto sono presenti in 52,5 ml di una soluzione 0,75 M di Acido Nitrico.
Quanti grammi di soluto sono necessari per preparare 1 litro di soluzione 0,2 M di nitrato piomboso?
Quanti grammi di cloruro di calcio devono essere aggiunti in 300 ml di acqua per ottenere una soluzione 2,46 m?
. Qual'è la molarità di 1,5 l di soluzione contenente 100 g di NaCl?
. Calcolare la molalità di una soluzione contenente 0,65 moli di glucosio (C6H12O6) in 250 g di acqua.
. Quanti ml di una soluzione 2.10-2 M posso ottenere con 6,2 g di fosfato di calcio ? E con 21,7 g dello stesso sale ?
. Quanti grammi di cloruro di bario sono presenti in 3,4 l di soluzione 3.10-l M? E in una stessa quantità di soluzione 3.10-l m?
. Quanti grammi di BaCl.2H2O devono essere utilizzati per ottenere 50 g di una soluzione 5,77*10-l M di BaCl2.
. Calcolare la massa di Al2(SO4)3.18H2O necessaria per ottenere 100 ml di una soluzione acquosa di concentrazione 40 g/l di Al3+.
. Si diluiscono 4 ml di una soluzione di acido solforico con acqua e si aggiunge un eccesso di BaCl2 in modo che tutto l'acido solforico precipiti sotto forma di BaSO4. Se precipitano 4,08 g di solfato di bario, qual'era la concentrazione della soluzione acida iniziale?
. Qual'è la molarità di una soluzione che contiene 20 g di zucchero (C12H22O11) sciolto in 125 g di H2O?
. Qual'è la molarità di un distillato a 40° alcoolici (concentrazione dell'alcool etilico CH3CH2OH 40% v/v) sapendo che la densità dell'alcool etilico è 0,8 g/cm3.
. Calcolare la molarità e la molalità di una soluzione di acido solforico di densità 1,2 g/cm3 di concentrazione 27% (p/p).
. Di quanto deve essere diluita una soluzione di nitrato di argento avente concentrazione 40 g/l per ottenere una concentrazione pari a 16 g/l ?
.Che volume di una soluzione di acido solforico concentrato avente densità 1,84 g/cm3 e contenente il 98% (p/p) di H2SO4 deve essere utilizzato e diluito per ottenere 100 ml di soluzione al 20% (p/p), con densità 1,14 g/cm3 ?
. Quanti ml di una soluzione di acido solforico al 98% (p/p), di densità 1,84 g/cm3 devono essere adoperati per preparare 1 litro di soluzione 1 N ?
. Quanti grammi di CrCl3.6H2O sono necessari per preparare 200 ml di una soluzione con [Cr3+] = 20 g/l ?
. Quanti ml di una soluzione CaCl2 con concentrazione 40 g/l sono necessari per reagire con 0,642 g di Na2CO3. Calcolare inoltre la molarità della soluzione di NaCl ottenuta.
. Quanti grammi di CaCl2 devono essere aggiunti a 300 ml di acqua per formare una soluzione 2,46 molale ?
. Calcolare la molalità di una soluzione contenente 57,5 ml di alcool etilico (CH3CH2OH - densità 0,8 g/cm3) in 600 ml di benzene (C6H6 - densità 0,9 g/cm3).
. Una soluzione di acido perclorico presenta una concentrazione del 35% (p/p) ed una densità di 1,25 g/cm3. Calcolarne la molarità e la molalità.
. Calcolare il volume di HCl concentrato al 38% (p/p) di densità 1,19 g/cm3 necessario a preparare 18 litri di soluzione 2.10-2 N.
. Determinare la massa di KMnO4 necessaria a preparare 80 ml di una soluzione 1,25.10-l N con il permanganato che si riduce a ione Mn2+.
. Disponendo di due soluzioni di HCl a concentrazione 12 N e 3 N, calcolare in che proporzione devono essere miscelate per ottenere 1 l di soluzione di HCl 6 N.
. Determinare il volume di una soluzione di acido nitrico diluito al 19% (p/p) con densità 1,11 g/cm3 che può essere preparato diluendo con acqua 50 ml di una soluzione dello stesso acido concentrata al 69,8% (p/p) avente densità 1,42 g/cm3. Calcolare inoltre la molarità e la molalità della soluzione diluita e di quella concentrata.
.Quale dovrebbe essere la molarità di una soluzione di K4Fe(CN)6 affinchè 40 ml di questa soluzione possano dissolvere 150 mg di Zn per formare K2Zn3[Fe(CN)6]2.
K2Cr2O7 + KI + HCl CrCl3 +KCl + I2 + H2O
Dopo aver bilanciato calcolare quanti grammi di bicromato di potassio reagiscono con 55 ml di una soluzione 2,25 N di ioduro di potassio e quanti grammi di iodio si formano.
. Un cubetto di rame di 2,5 cm di lato avente densità 8,3 g/cm3 puro al 95% viene lasciato cadere in una soluzione 6 M di acido nitrico. Calcolare quanti ml di tale soluzione reagiscono con tutto il rame.
. Calcolare quanti grammi di I2 si formano impiegando 125 ml di una soluzione 1 N di permanganato di potassio dalla seguente reazione (da bilanciare):
KMnO4 + KI + H2SO4 K2SO4 + MnSO4 + I2 + H2O
. Calcolare il numero di equivalenti di Al2(SO4)3 che si formano nella reazione tra un eccesso di idrossido di alluminio e 250 g di acido solforico. Calcolare inoltre quanti grammi di idrossido reagiscono.
. Calcolare quanti ml di H2SO4 3 N e quanti ml di H2SO4 0,5 N bisogna mescolare per ottenere un litro di soluzione 1 N.
. A 50 ml di una soluzione 4 M di acido ortoborico vengono aggiunti 450 ml di una soluzione 2 N dello stesso acido. Calcolare la normalità della nuova soluzione.
RISPOSTE
a) 147 gr di H2SO4
b) 122 gr di NaClO4
c) 0,85 gr AgBr
a) [H2S] M = 2,18 m = 2,36 c
b) [KCN] M = 0,1 m = 0,13 c
c) [Cl2O7] M = 0,19 m = 0,2 c
3. 53,1 g di Ba(OH)2
4. 2,44 g di HNO3
5. 66,24 g
6. 81,9 g
7. 1,14 M
8. 2,6 m
9. 1000 ml 3500 ml
10. 212,16 g 199,7 g
11. 7 g di BaCl2 su 43 g di acqua
12. 49,37 g
13. 4,37 M
14. 0,4 M
15. 6,96 M
16. 3,3 M 3,77 m
17. del 150% (1,5 l di acqua per ogni litro di soluzione iniziale)
18. 12,64 ml, corrispondenti a 23,265 g di soluzione al 98 %
19. 27,17 ml
20. 20,5 g
21. 16,8 ml 0,7 M
22. 82 g
23. 1,85 m
24. 4,35 M 5,36 m
25. 29 ml
26. 0,316 g
27. 2/3 di soluzione 3N + 1/3 di soluzione 12 N
28. 236 ml Mdil = 3,35 Mconc = 15,7 mdil = 3,72 mconc = 36,7
29. 3,82*10-2 M
30. coefficienti stechiometrici (1,6,14 - 2,8,3,7) 6,06 g 15,7 g
31. 646 ml
32. coefficienti stechiometrici (2,10,8 - 6,2,5,8) 15,9 g
33. 5,1 eq 132,6 g
34. 800 ml 0,5 N + 200 ml 2 N
35. 3 N
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta