| chimica |
|
DETERMINAZIONE DELLA CMC DELLfSDS MEDIANTE SPETTROSCOPIA U.V.
In questa
esperienza viene determinata
Questa
tecnica ci permette di sfruttare la proprietà delle micelle di solubillizzare
nel core sostanze idrofobe. Il core delle micelle è formato dalle catene
idrocarburiche, che hanno carattere apolare, mentre la superficie di tali
micelle è formata dalle teste polari che ne permettono la solubilizzazione in
acqua. Il core della micelle si comporta come un idrocarburo liquido
costituendo una fase apolare. Per determinare

Entrambe le forme tautomeriche assorbono nellfUV, in particolare la forma chetonica a 250 nm mentre la forma enolica a 315 nm.
Nelle
soluzioni in cui la concentrazione di SDS è minore del valore della CMC,
lfequilibrio del BZA è spostato verso la forma tautomerica più stabile in
acqua, ovvero quella chetonica; a valori al di sopra della CMC è presente anche
una fase apolare (il core delle micelle): lfequilibrio del BZA si sposta verso
la forma enolica stabilizzata dalla fase apolare non presente a valori di
concentrazione minore della CMC. Attraverso misurazioni di assorbanza di
soluzioni a concentrazione di BZA costante (10mg/dm3) ma a
concentrazioni di SDS diverse, si registra lfandamento delle concentrazioni
delle due specie tautomeriche nelle varie soluzioni di tensioattivo. Quando
avviene un vistoso spostamento dellfequilibrio dalla parte della forma enolica
significa che si sono formate micelle.
Svolgimento
Vengono
preparate sette soluzioni di tensioattivo nel gsolventeh BZA/H2O a
diverse concentrazioni (2, 4, 6, 9, 12, 15,
Dopo la preparazione delle soluzioni viene tarato lo strumento col bianco
(acqua milli-Q) nel range 200-360 nm. Si procede misurando lfandamento
dellfassorbanza delle soluzioni di SDS partendo dalla più diluita. Infine
determinare lfassorbanza delle soluzioni a 250 nm e a 315 nm. Per le
misurazioni vengono utilizzate cuvette in quarzo (cammino ottico l pari
a
Calcoli
·
Preparazione
soluzione SDS
PMSDS=288.38 mg/mmol MSDS=1.8*10-
![]()
![]()
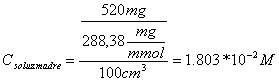
![]()
· Preparazione soluzioni SDS diluite.
Csoluz.madre=1.803*10-2M Vfinale=25 cm3
![]()
|
Cfinale (M) |
Vsoluz.madre (cm3) |
|
2,00E-03 |
|
|
4,00E-03 |
|
|
6,00E-03 |
|
|
9,00E-03 |
|
|
1,20E-02 |
|
|
1,50E-02 |
|
Per la preparazione delle soluzioni diluite, i volumi della soluzione madre da prelevare sono stati garrotondatih per facilitarne il prelievo.
|
Vsoluz.madre (cm3) |
Cfinale (M) |
|
|
2,16E-03 |
|
|
4,01E-03 |
|
|
5,77E-03 |
|
|
9,02E-03 |
|
|
1,19E-02 |
|
|
1,44E-02 |
|
CSDS (mM) |
A315nm |
A250nm |
|
2,16E-03 |
|
|
|
4,01E-03 |
|
|
|
5,77E-03 |
|
|
|
9,02E-03 |
|
|
|
1,19E-02 |
|
|
|
1,44E-02 |
|
|
|
1,80E-02 |
|
|
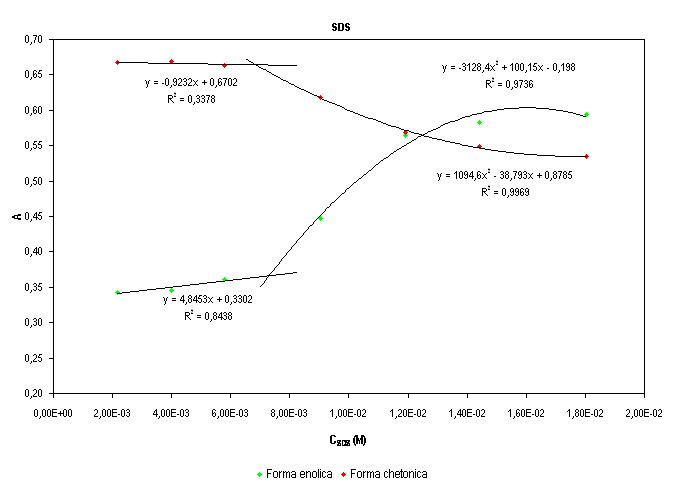
Da questo grafico si possono ottenere due distinti valori di CMC determinati dallfintersezione delle rette con le polimoniali. I due valori della CMC vengono calcolati risolvendo i seguenti sistemi:
CMCchetonica
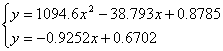
Da questo sistema si trovano due
possibili valori della CMC:
CMCenolica
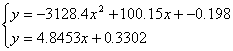
Da questo sistema si trovano due
possibili valori della CMC:
Si ottiene un valore di CMC pari a
7.07*10-
Il valore dellfassorbanza in funzione della concentrazione della specie che assorbe segue la legge di Lambert-Beer:
![]()
dove A è lfassorbanza ad una determinata l e il coefficiente di estinzione molare, c la concentrazione molare e l il cammino ottico. In questo caso le specie che assorbono in soluzione sono due: la forma chetonica e quella enolica del BZA che assorbono rispettivamente a 250 nm e 315 nm. Lfassorbimento di una soluzione di SDS registrato dallo spettrometro a 250 nm può essere considerato causato solo dalla forma chetonica dato che a quella l echetonica >> eenolica; a l di 315 nm, invece, si ha che echetonica << eenolica perciò si può considerare che assorbe solo la forma enolica. La variazione dellfassorbanza delle due specie tautomere nelle diverse soluzioni di SDS è imputabile solo a una variazione di concentrazione delle stesse dato che l e el sono costanti. Nelle misurazioni vengono utilizzate cuvette di quarzo e non di vetro perché questf ultimo, a differenza del quarzo, assorbe nel range di lunghezze dfonda in cui si opera.
Dal grafico
e dalla tabella sopra riportati si nota che per le prime tre soluzioni di SDS (
Passando
dalla soluzione
Teoricamente i valori di CMC ottenuti per via grafica devono essere identici; in realtà ciò non accade. Questo discostamento è dovuto a errori sperimentali che portano a rette di regressione e curve polinomiali approssimate in modo differente per la forma enolica e per quella chetonica.
Il valore
della CMC ottenuto con questo metodo e con quello conduttimetrico è diverso
(CMCspettr=7.07*10-
Confrontando il grafico ottenuto con il metodo spettrometrico con quello ottenuto con il metodo conduttimetrico si nota che i coefficienti di correlazione (R2) delle varie linee di tendenza sono migliori (più vicino a 1) con la determinazione conduttimetrica. Nel metodo spettrometrico, invece, i valori di R2 sono molto minori di 1, ciò indica una minore correlazione tra i valori ottenuti, con la conseguenza di ottenere valori meno accurati di CMC. Per porre rimedio a questo problema si dovrebbe preparare un maggior numero di soluzioni di SDS a concentrazioni sempre più simili; in questo modo si otterrebbe un maggior numero di valori di assorbanza, di conseguenza degli R2 delle linee di tendenza vicini ad 1 e quindi valori di CMC più accurati.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta