| chimica |
|
Determinazione della costante di dissociazione di un acido debole (VBC)
con metodo spettrofotometrico
Introduzione Teorica
L'esperienza è basata sulla determinazione della costante di dissociazione di un acido debole sfruttandone il diverso colore e, quindi, il diverso assorbimento, a seconda del pH.
L'analita utilizzato, il Verde di Bromocresolo (VBC) è, infatti, normalmente impiegato nelle titolazioni colorimetriche con punto di equivalenza compreso tra pH 3,8 e 5,4, zona in cui cambia colore da un giallo intenso ad una blu deciso, passando un verde deciso che indica il momento effettivo di viraggio.
Ciò di cui ci occupiamo, una costante di dissociazione, è un caso particolare di una famiglia molto più ampia di costanti, quelle di equilibrio termodinamico.
Ogni reazione ha una sua costante di equilibrio, slegata dalla pressione e legata, invece, alla temperatura, che determina un rapporto tra prodotti e reagenti che viene sempre raggiunto all'equilibrio. Per ottenere una maggior precisione, la costante di equilibrio andrebbe espressa tramite le attività (elevate ai rispettivi coefficienti stechiometrici), ma molto spesso si approssimano le attività con le concentrazioni (espresse in molarità). Prendendo in considerazione una generica reazione:
aA + bB → γC + dD
la sua costante di equilibrio si può esprimere come:
Keq = ![]()
La costante di equilibrio esprime quanto siano stabili i prodotti rispetto ai reagenti, permette di prevedere quale sarà l'effetto di una perturbazione esterna su un sistema all'equilibrio (basandosi sul principio di Le Chatelier) ed è collegata all'energia libera di GIbbs dalla formula:
![]()
Oltre che all'entalpia tramite l'equazione di Van't Hoff:
![]()
Le costanti di dissociazione sono casi particolari delle costanti di equilibrio, che godono delle stesse proprietà e vengono formulate nel medesimo modo. Ciò che cambia è la reazione che governano, cioè la dissociazione di un acido o di una base debole in un solvente. Pertanto la costante di equilibrio, diventata costante di dissociazione, assume, ad esempio per un acido, l'espressione:
aA → bB + H+
Keq =![]()
La nostra esperienza si basa sul fatto che la costante di dissociazione dipenderà dal pH della soluzione, essendo presente la concentrazione dello ione idrogeno nella sua espressione, e dalla concentrazione delle due specie in equilibrio che sono, per colore, molto diverse tra loro. La reazione può essere così rappresentata:


![]()
+ H+
![]()
"B", blu
(forma sodica) "G", giallo
La costante di dissociazione è così espressa:
![]()
![]() Da cui si ricava
Da cui si ricava
Mentre l'informazione del pH è facilmente reperibile partendo da soluzioni a pH noto, il calcolo delle concentrazioni partendo dall'informazione colorimetrica ci porta a dover introdurre un altro aspetto teorico.
Infatti, le concentrazioni delle due specie vengono calcolate tramite misurazioni spettrofotometriche di assorbanza, nel range del visibile, ad una data concentrazione totale di VBC. Lo spettrofotometro, una volta inserito un campione, ci fornisce un grafico di assorbimento, avente in ascissa le lunghezze d'onda e in ordinata l'assorbanza.
L'assorbanza è l'entità della radiazione assorbita, detta anche estinzione, e può essere espressa tramite l'equazione di Lambert- Beer:
dove c : concentrazione (mol dm-3)
l : cammino ottico (cm)
e l : coefficiente di estinzione molare alla lunghezza d'onda l (dm3 mol-l cm-l)
Si nota che questa non è altro che l'equazione di una retta, in cui la variabile indipendente è la concentrazione e quella dipendente l'assorbanza. Il prodotto tra cammino ottico e coefficiente di estinzione molare rappresenta, invece, il coefficiente angolare.
Il cammino ottico è dettato dalla lunghezza del tratto del raggio incidente nel campione, ed è, quindi, una caratteristica fisica delle cuvette utilizzate. Il coefficiente di estinzione è, invece, una costante tipica di ogni sostanza, dipendente dalla frequenza (e quindi lunghezza d'onda) della radiazione incidente ed è massimo quando l'assorbimento è più intenso.
Va citato anche che, quando in uno stesso campione sono presenti due specie che assorbono alla stessa lunghezza d'onda, l'equazione di Lambert-Beer viene modificata introducendo la concentrazione di entrambe le specie e i relativi e l a quella data l. Pertanto l'equazione diventa:
Svolgimento
In laboratorio ci vengono fornite cinque diverse
soluzioni: una HCl
Si preparano cinque cuvette (oltre al bianco),
ognuna con 200ml di VBC e 2 ml di una delle soluzioni fornite, ottenendo così
soluzioni con la stessa concentrazione totale di analita, ma diverso pH e
quindi diversa percentuale delle due specie. Dalla soluzione contenente HCl
Una volta calcolata la concentrazione di VBC si procede con le rilevazioni sulle cinque cuvette, ottenendo un grafico dove, in ogni curva tranne che in quella relativa all'acido cloridrico, sono presenti due picchi.
La curva della soluzione con HCl
Oltre alla lunghezza d'onda di massimo assorbimento per le due specie, ciò che otteniamo dal grafico, sono i valori delle assorbanze a seconda dei vari pH del campione.
Per poter ottenere le concentrazioni delle due specie nelle soluzioni tamponi, e, da qui, la costante di dissociazione, vanno calcolati i valori dei coefficienti di estinzione molare. Tramite retta di regressione calcoliamo i tre di cui abbiamo bisogno, eG,lGmax, eB,lBmax, eB,lGmax.
Applicando, quindi, la legge di Lambert-Beer per una sola specie possiamo determinare la concentrazione di forma "blu" presente nel tampone. Da questa, poi, con la legge di Lambert-Beer per più specie, si riesce ad ottenere la concentrazione di forma "gialla" nella soluzione considerata.
Si termina applicando la formula per il calcolo della costante di dissociazione e della sua pKa
Calcoli, tabelle e grafici
Calcoli per determinare la concentrazione di VBC nel campione:
Si determina prima la molalità partendo dalla percentuale in peso e dal peso molecolare medio delle due forme:
PM forma "gialla" =
PM forma "blu" =
PM medio =
m =![]() =5,6*10-4
g/mol solvente
=5,6*10-4
g/mol solvente
considerando la molalità simile alla molarità (in questo caso), si può dire che quest'ultima sia:
M=5,6*10-4 g/l.
Si può ora calcolare la concentrazione dell'analita nei vari campioni:
M= ![]()
Calcolo dei coefficienti di estinzione molare
Per ottenere le concentrazioni delle due specie nelle soluzioni tamponi, bisogna conoscere tre e: quello della l massima del giallo misurata sul campione giallo, quello della l massima del giallo misurata sul campione blu e quello della l massima del blu misurata sul campione blu.
Per ottenere questi tre valori abbiamo fatto
quattro misure a diverse concentrazioni di VBC in soluzione acida (portando a
2,2 ml il volume nella cuvetta mediante HCl
Le tabelle delle concentrazioni e delle assorbanze corrispondenti è:
|
Concentrazione VBC (M) |
AbslGmax |
|
5,09E-05 |
|
|
2,55E-05 |
|
|
1,27E-05 |
|
|
6,36E-06 |
|
|
Concentrazione VBC (M) |
AbslGmax |
AbslBmax |
|
5,09E-05 |
|
|
|
2,55E-05 |
|
|
|
1,27E-05 |
|
|
|
6,36E-06 |
|
|
La prima tabella si riferisce alle rilevazioni di assorbanza per la lmassima del giallo alle varie concentrazioni in soluzione acida, la seconda alle rilevazioni di assorbanza per l=442 nm e l =616 nm in soluzione basica.
Le concentrazioni non sono casuali, le abbiamo ottenute dimezzando la concentrazione precedente, partendo dal valore datoci in ricetta.
Mediante le tabelle è possibile realizzare un grafico che mostra tre rette il cui coefficiente angolare è esattamente il coefficiente di estinzione (se l'intercetta è impostata nell'origine), dato che il cammino ottico nel nostro caso specifico è l =1 cm. Il grafico relativo è:
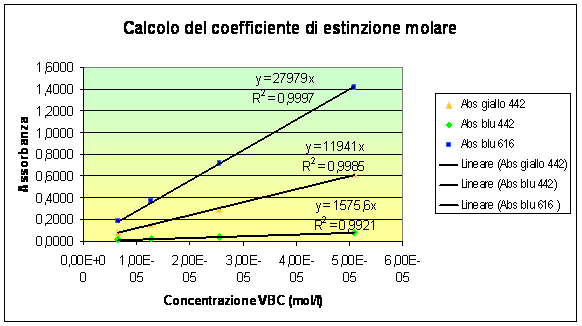
Si ottengono così i tre valori desiderati:
|
eG,lGmax |
|
|
eB,lGmax |
|
|
eB,lBmax |
|
Calcolo della concentrazione delle due specie nei vari tamponi
Per determinare la concentrazione di VBC in forma basica applichiamo la legge di Lambert-Beer classica, mentre, per determinare quella della forma acida utilizziamo la legge di Lambert-Beer per più specie. Le due fomule, rispettivamente, sono:
![]()
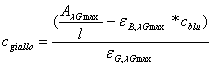
Calcolo della costante di dissociazione
Al termine di questi calcoli vi sono tutte le variabili per poter determinare la costante di dissociazione del VBC. Per farlo si applica la legge espressa all'inizio:
![]()
I risultati ottenuti si possono riassumere nella tabella:
|
Cuvetta 2: solo forma G |
|
|
|
|
|
||
|
lGmax |
|
nm |
A |
|
l |
|
cm |
|
eG,lGmax |
|
dm3 mol-lcm-l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cuvetta 3: solo forma B |
|
|
|
|
|
||
|
lBmax1 |
|
nm |
A |
|
l |
|
cm |
|
eB,lBmax1 |
|
dm3 mol-lcm-l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lGmax |
|
nm |
A |
|
l |
|
cm |
|
eB,lGmax |
|
dm3 mol-lcm-l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cuvetta 4 (pH 3.56) |
|
|
|
|
|
|
|
|
lBmax1 |
|
nm |
A |
|
l |
|
cm |
|
eB,lBmax1 |
|
dm3 mol-lcm-l |
cB |
3,91365E-06 |
M |
|
|
|
|
|
|
|
|
|
|
|
|
lGmax |
|
nm |
A |
|
l |
|
cm |
|
eG,lGmax |
|
dm3 mol-lcm-l |
cG |
4,8173E-05 |
M |
|
|
|
eB,lGmax |
|
dm3 mol-lcm-l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cuvetta 5 (pH 4) |
|
|
|
|
|
|
|
|
lBmax1 |
|
nm |
A |
|
l |
|
cm |
|
eB,lBmax1 |
|
dm3 mol-lcm-l |
cB |
9,36417E-06 |
M |
|
|
|
|
|
|
|
|
|
|
|
|
lGmax |
|
nm |
A |
|
l |
|
cm |
|
eG,lGmax |
|
dm3 mol-lcm-l |
cG |
3,88197E-05 |
M |
|
|
|
eB,lGmax |
|
dm3 mol-lcm-l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cuvetta 6 (pH 4.62) |
|
|
|
|
|
|
|
|
lBmax1 |
|
nm |
A |
|
l |
|
cm |
|
eB,lBmax1 |
|
dm3 mol-lcm-l |
cB |
2,3053E-05 |
M |
|
|
|
|
|
|
|
|
|
|
|
|
lGmax |
|
nm |
A |
|
l |
|
cm |
|
eG,lGmax |
|
dm3 mol-lcm-l |
cG |
2,52054E-05 |
M |
|
|
|
eB,lGmax |
|
dm3 mol-lcm-l |
|
|
|
|
|
In ultimo, la tabella circa i valori calcolati di pKa:
|
Cuvetta nr. |
pKapuntuale |
|
|
|
|
|
|
|
|
|
Il valore sperimentale ottenuto, infine, è:
pKa=4,64![]() 0,0217.
0,0217.
Conclusione teoriche
Analizzando i primi grafici effettuati con le diverse soluzioni a concentrazione di VBC costante ( M = 5,09*10-5 mol/l ) possiamo dire che:
Ø
dal primo grafico, effettuato sul
campione in HCl
Ø
dal secondo grafico, cioè
quello in soluzione NaOH
Ø dai tre grafici delle soluzioni tamponi, vediamo la presenza, come ci si sarebbe aspettato, di due picchi, uno nella zona dei 616 nm e uno intorno ai 440 nm, legati all'assorbimento solo della specie in forma basica del primo e di entrambe le specie il secondo. Aumentando il pH si nota un'abbassamento del primo picco e un innalzamento del secondo, ciò è collegato all'aumentare della forma basica, e conseguente diminuzione di quella acida, spostandoci verso pH più alti.
Dopo aver trovato le due l massime, quella della forma acida e quella della forma basica, siamo passati al calcolo dei coefficienti di estinzione molare tramite retta di taratura.
Vi sono varie osservazioni da fare circa questi calcoli:
Ø dalle quattro misure a diverse concentrazioni di soluzione acida si raccolgono solo i valori di assorbenza alla l massima della forma gialla. Mettendoli in grafico contro le molarità si ottiene la retta il cui coefficiente angolare è eG,lGmax .
Ø dalle quattro misure a diverse concentrazioni di soluzione basica si raccolgono, invece, i valori alla l massima della forma gialla e quelli alla l massima della forma blu. Mettendo in grafico entrambe le serie di valori si ottengono due rette da cui si ottiene, rispettivamente, eB,lGmax e eB,lBmax .
Da sottolineare il fatto che abbiamo calcolato eB,lGmax e non e alla lunghezza d'onda del picco più basso del blu. Ciò è stato fatto per il successivo calcolo della pKa tramite le informazioni derivanti dai grafici delle soluzioni tampone.
Le tre rette hanno pendenza diversa, indice della maggiore o minore assorbenza del composto alla data lunghezza d'onda.
La pendenza minore è quella della forma basica a l = 442 nm, ciò è in accordo con l'aspettativa teorica, dato che il picco presentato dalla forma basica in quella zona dello spettro è basso e poco significato per il riconoscimento stesso della specie basica, oltretutto i calcoli non sono effettuati nel punto di massimo, ma in fase di discesa.
La retta della forma acida a l = 442 nm ha pendenza maggiore, ma pur sempre minore di quella della forma basica a l = 616 nm. Questo sta ad indicare che la massima assorbenza della forma blu è in ogni caso maggiore di quella della forma giallo.
Come precedentemente detto, dai tre grafici prendiamo in considerazione le assorbanze a 616 nm e a 442 nm. La forma acida non assorbe nella zona del blu quindi non bisogna fare correzioni su questo picco, da cui si ricava direttamente la concentrazione della forma basica nei tre tamponi.
Il caso della l massima della forma gialla è diverso, il picco nei tre grafici è legato non solo alla concentrazione della forma acida, ma anche a quella della forma basica a causa del piccolo picco che presenta anche nel grafico a pH basico.
L'assorbanza a 442 nm dev'essere espressa con l'equazione di Lambert-Beer modificata ed è proprio per questo motivo che abbiamo calcolato anche il coefficiente di estinzione a questa lunghezza d'onda, e non a quella di picco, per la forma basica.
I valori dell'assorbanza rilevati alla l = 442 nm per le soluzioni di VBC a diversa concentrazione in soluzione acida, ci danno eG,lGmax
Tramite le soluzioni di VBC a diversa concentrazione in soluzione basica, otteniamo con le assorbanze raccolte a 442 nm eB,lGmax e con quelle raccolte a 616 nm eB,lBmax
Gli ultimi calcoli ci permettono d conoscere le concentrazioni e, da queste, la costante di dissociazione. Quest'ultima operazione si divide in tre parti:
Ø per ogni grafico relativo ad una soluzione tampone calcoliamo, dall'assorbanza, la concentrazione della forma basica di VBC a seconda del pH. Utilizziamo l'equazione di Lambert-Beer standard perché la forma acida non assorbe in quel range.
Ø per ogni grafico relativo ad una soluzione tampone calcoliamo, dall'assorbanza, la concentrazione della forma acida di VBC a seconda del pH. Utilizziamo, però, l'equazione modificata di Lambert-Beer considerando il contributo della forma basica tramite il fattore eB,lGmax C B.
Ø
una volta ottenute le tre coppie
di valori di concentrazioni, si calcolano le tre costanti di dissociazione, si
trovano le tre pKa, se ne fa la media e la deviazione standard ( in
modo da avere una stima dell'errore commesso). Il valore da noi trovato
sperimentalmente è: pKa = 4,64![]() 0,0217,
il valore tabulato per la pKa del verde di bromocresolo è
4,7, quindi abbiamo ottenuto un risultato in buon accordo col valore tabulato e
con una bassa deviazione ( 0,46% ).
0,0217,
il valore tabulato per la pKa del verde di bromocresolo è
4,7, quindi abbiamo ottenuto un risultato in buon accordo col valore tabulato e
con una bassa deviazione ( 0,46% ).
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta