| chimica |
|
EQUAZIONE DI NERST.
Vediamo ora come individuare la dipendenza del voltaggio di una cella galvanica dalla concentrazione delle specie chimiche.
Tale dipendenza è espressa dalla equazione di Nerst, secondo cui, per la generica reazione:
![]()
si ha, a 25░C, una differenza di potenziale paria a:
|
|
dove il quoziente Q è dipendente dalle concentrazioni nelle specie A, B, C e D ed è definito da:
![]()
e dove DE░ è il potenziale standard di cella, n è il numero di elettroni trasferiti nella reazione così come scritta e il logaritmo è preso in base 10.
Dim.
Tale equazione può essere ricavata da grandezze termodinamiche. Sappiamo infatti che per la generica reazione
![]()
la variazione di energia libera può essere posta nella forma:
![]()
ma tale variazione di energia libera corrisponde anche al massimo lavoro utile ottenibile da una reazione chimica, che, nel caso della reazione di ossido-riduzione che si realizza nella cella galvanica, coincide con il prodotto della carica q che la cella può fornire per il suo potenziale di cella DE:
![]()
Posto F (Faraday) il valore della carica espressa in Coulomb relativa ad una mole di elettroni (F=e N=1,6 10-l9 96500 C/mol), la carica che passa sarà data da:
![]()
Pertanto si ha:
![]()
e passando ai logaritmi decimali invece di quelli naturali:
![]()
C.V.D.
L'equazione di Nerst, quindi mostra come il potenziale di cella dipenda dalla concentrazione delle specie chimiche. Inoltre essa suggerisce che si potrebbe generare una differenza di potenziale anche utilizzando semplicemente una differenza di concentrazione, anche se il potenziale standard della cella è zero.
Ad esempio, si consideri una cella formata da un elettrodo di argento immerso in una soluzione 1 M di Ag+ in una semicella e costituita da un filo di argento che pesca in una soluzione 0,01 M di Ag+ nell'altra semicella. Una cella di questo tipo è definita cella di concentrazione. Gli esperimenti mostrano che si genera una differenza di potenziale e che l'elettrodo immerso nella soluzione più diluita è più negativo. Pertanto le semi-reazioni che avvengono devono essere:
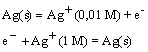
e la reazione di cella è:
![]()
Cioè, l'azione spontanea della cella tende a eguagliare le due concentrazioni. Il voltaggio standard della cella è zero, ma il voltaggio generato in tali circostanze è:
![]()
Il fatto che esiste una differenza di potenziale per queste reazioni non dovrebbe sorprendere. Si sa, infatti, che se una soluzione concentrata è posta in contatto fisico con una soluzione diluita, le due si mescoleranno spontaneamente per diffusione per formare una soluzione a concentrazione intermedia uniforme. Ed è proprio questa tendenza naturale delle due soluzioni a mescolarsi che è misurata dal voltaggio di questa cella a concentrazione.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta