| chimica |
|
CHIMICA

in
generale
Valenze:
 Gas
Nobili 0 Zinco 2
Gas
Nobili 0 Zinco 2
Gruppo N.O. (valenza) Idrogeno 1 Mercurio 1,2
I +1 Cromo 2,3,6 Argento 1
II +2 Manganese 23467 Rame 1,2
III +3 Ferro 2,3 Piombo 2,4
 atomi di H con il
quale un atomo di un dato elemento
si combina o reagisce.
"
v:shapes="_x0000_s1029"> IV +4 +2 (-4) Nichel 2,3 Ossigeno -l,-2 V -3
+5 +3 (-l)
atomi di H con il
quale un atomo di un dato elemento
si combina o reagisce.
"
v:shapes="_x0000_s1029"> IV +4 +2 (-4) Nichel 2,3 Ossigeno -l,-2 V -3
+5 +3 (-l)
VI -2 +6 +4 (+2)
VII -l +7 +5 +3 +1
Esistono 5 principali classi di Composti:
Ossidi Basi
 Metalli + O2 Þ Ossidi
Basici + H2O Þ Idrossidi
Metalli + O2 Þ Ossidi
Basici + H2O Þ Idrossidi
Þ Sali
Anidridi
NonMetalli + O2 Þ Ossidi
Acidi + H2O Þ Acidi
Nomenclatura IUPAC (composti inorganici):
Prefisso Suffisso
 Ossidi e Acidi: IPO yyyy OSO (-)
Ossidi e Acidi: IPO yyyy OSO (-)
- yyyy OSO
- yyyy ICO
PER yyyy ICO (+)
![]() Sali: IPO yyyy
ITO (-)
Sali: IPO yyyy
ITO (-)
di XXX
- yyyy ITO
- yyyy ATO
PER yyyy ATO (+)
Costruire la Formula (schema fantachimico):

Composti:
Binari Þ metodo "della Crocetta"
Ternari
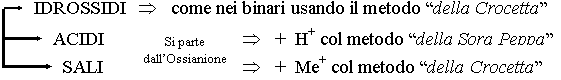
Þ
Regola generale: tutti i composti devono risultare sempre elettricamente neutri
Composti Binari :
Gli OSSIDI sono composti di un qualunque elemento (metallo o non-metallo) con l'ossigeno nello stato di valenza -2. La forma generica è XO combinati secondo la regola della crocetta:

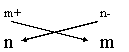
Regola della Crocetta: X Y esempio: Al3+ O2- Þ Al2O3
il composto è neutro infatti 2 (+3) = 6 e 3
se m e n sono divisibili per uno stesso numero la formula si semplifica: S2O6 = SO3
Composti Ternari:
Gli IDROSSIDI sono composti formati da un metallo e lo ione (OH)-: Me(OH)

![]() Si applica anche in
questo caso il metodo della crocetta tra metallo e ione come se fosse un
composto binario: esempio: Mg2+ (OH)- Þ Mg(OH)2
Si applica anche in
questo caso il metodo della crocetta tra metallo e ione come se fosse un
composto binario: esempio: Mg2+ (OH)- Þ Mg(OH)2
Gli ACIDI sono composti formati da idrogeno con valenza +1, un non-metallo, e l'ossigeno nella valenza -2. La forma generica è: HNmO

![]() Regola della sora Peppa: "sommo le cariche
positive, divido per due e il risultato lo attribuisco ad O. Se la somma delle
cariche positive NON è divisibili per due allora aggiungo un H e
riprovo".
Regola della sora Peppa: "sommo le cariche
positive, divido per due e il risultato lo attribuisco ad O. Se la somma delle
cariche positive NON è divisibili per due allora aggiungo un H e
riprovo".
H+ I+5 O-2 Þ HIO3 H+ C+4 O-2 Þ H2CO3
I SALI sono composti formati dall'ossianione di un Acido e il metallo di un Idrossido. La forma generica è MeNmO.

In pratica si stacca l'H dall'acido e al suo posto si aggancia il metallo dell'idrossido. Bisogna calcolare che la carica complessiva dell'ossianione deve neutralizzare quella del metallo. I due membri vanno combinati con il metodo della crocetta.
metallo ossianione
Esempio: Carbonato
di Magnesio Mg2+ + (C4+O2-)2+
 Mg2+ + (C4+O2-3)2-
Mg2+ + (C4+O2-3)2-
Infatti:
Mg(OH)2 + H2CO3 = MgCO3 + 2H2O
 alcuni composti, tra cui quelli contenenti:
Boro, Fosforo, Arsenico, Silicio
"
v:shapes="_x0000_s1152">ATTENZIONE: alcuni composti
hanno la tendenza ad inglobare acqua atmosferica. Si avranno in questo caso
due versioni del composto:
alcuni composti, tra cui quelli contenenti:
Boro, Fosforo, Arsenico, Silicio
"
v:shapes="_x0000_s1152">ATTENZIONE: alcuni composti
hanno la tendenza ad inglobare acqua atmosferica. Si avranno in questo caso
due versioni del composto:
con acqua Þ orto composto normale
senza acqua Þ meta solo in laboratorio
Altri composti (più esotici):
Gli IDRACIDI (V.N.) sono composti binari dell'idrogeno (valenza sempre +1) con un non-metallo (acidi binari). Seguono anch'essi la regola della crocetta. La forma generica è HNm e prendono il suffisso idrico. Esempio: HF = acido fluoridrico
Gli IDRURI (IUPAC) sono ancora composti binari dell'idrogeno e seguono la regola della crocetta. Si dividono in idruri covalenti (H nella valenza +1) e idruri salini (H con valenza -l). La forma generica è HX e il nome idruro di X.
SALI BINARI: sono binari perché provenienti da un Idracido. La forma generica è: MeNm e prendono il nome di Nmuro di Me.
I SALI ACIDI sono quelli in cui rimane qualche H dall'acido. Nella nomenclatura prendono la desinenza biX, idrogenoX, mono/bi acido o mono/di idrogeno.
Esempi: Na2HPO4 bifosfatodisodio o idrogenofosfatodisodio o fosfato monoacido di sodio
NaH2PO4 diidrogenofosfatodisodio o fosfato biacido di sodio
I SALI DOPPI sono quelli formati da due ossidi e un acido e quindi conterranno due metalli e un non metallo. Prendono la desinenza doppio.
Esempio: NaKSO4 solfato doppio di sodio e potassio
PEROSSIDI: ossidi in cui l'O ha eccezionalmente valenza -l.
SUPEROSSIDI: ossidi in cui l'O ha eccezionalmente valenza -l/2.
Esempi di nomenclatura e formule:
FeO ossido ferroso Fe(OH)2 idrossido ferroso
Fe2O3 ossido ferrico Fe(OH)3 idrossido ferrico
H2SO3 acido solforoso HNO2 acido nitroso
H2SO4 acido solforico HNO3 acido nitrico
H2SiO3 acido metasilicico H4SiO4 acido ortosilicico
HPO2 acido fosforoso HPO3 acido metafosforico
H3PO3 acidoortofosforoso H3PO4 acido ortofosforico
ipoiodito di calcio Ca(IO)2 metaarsenito di alluminio Al(AsO2)3
monoH ortoborato di Na Na2HBO3 nitrito di magnesio Mg(NO2)2
bisolfito ferrico Fe(HSO3)3 perclorato di bario Ba(ClO4)2
idrossido di alluminio Al(OH)3 solfato di alluminio Al(HSO4)3
anidride solforosa (V.N.) SO3 anidride fosforosa (V.N.) P3O2
ammoniaca (V.N.) NH3 fosfina (V.N.) PH3
soda caustica (V.N.) NaOH
ione Ammonio (NH4)+ ione Acidato (CH4COO)-
ione Ossalato (C2O4)-2 acido formico HCOOH
Conversioni :
°K = 273 + °C
1 Atm = 760 Torr = 101325 Pa - 1 Pa = 9,87 10-6 Atm
1 Torr = 0,00131 Atm = 133,3 Pa = 1mm Hg a 0 C
1l = 1 dm2
Rapporti ponderali:
Numero Atomico: Z = N° di elettroni (= N° dei protoni) è il numero d'ordine della tavola periodica.
Peso Atomico: P.a. = massa rapportata ad 1/12 dell'atomo di C (P.a. del H = 1)
Peso Molecolare: P.m. = somma dei pesi atomici degli atomi che compongono la molecola.
Peso Formula: P.f. = somma dei pesi atomici nei composti ionici (che non sono molecole discrete).
Peso Equivalente: P.eq. = quantità in peso che reagisce con 1g di H (P.eq. O = 8,00 g)
il Peq di una sostanza che si forma o reagisce in una reazione di Þ Idrolisi = Pf / n e
![]() Neutralizzazione = Pm / n H+
Neutralizzazione = Pm / n H+
Ossidoriduzione = Pm / n e
N di equivalenti: N.e. = g / Pe
Mole: 1 mole di entità = un numero di Avogadro di pezzi = 6,02 1023 pezzi
 Grammoatomo: quantità
in g º Pa
Grammoatomo: quantità
in g º Pa
Grammomolecola: quantità in g º Pm
Grammoformula: quantità in g º Pf
N di moli: n = grammi di sostanza / peso di una mole = g / Pa = g / Pm = g / Pf
Molarità: M = n / Vl = g / (Pm Vl) (numero moli di soluto in 1l di soluzione)
Formalità: F = nPf / Vl (numero di Pf di soluto in 1l di soluzione)
Normalità: N = Ne / Vl = g / (Peq Vl) (numero di equivalenti in 1l di soluzione)
Molalità: m = n / Kg (numero moli di soluto in 1Kg di solvente)
Leggi dei Gas Ideali:
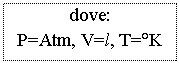 L. di Boyle: P1 V1 = P2 V2 quando T = K
L. di Boyle: P1 V1 = P2 V2 quando T = K
L. di Charles: P1 / T1 = P2 / T2 quando V = K
L. di Gay-Lussac: V1 / T1 = V2 / T2 quando P = K
Equazione di stato: P V / T = P V / T (date tutte le condizioni iniziali e due delle finali)
per n moli di Gas si ha: P V = n R T ovvero P V = (g / Pm) R T
Þ (T è sempre
in K
dove R = 0,0821 se la pressione è in Atm e il volume è in l
dove R = 82,1 se la pressione è in Atm e il volume è in ml
Densità: d = g / V Þ d = P Pm / R T
e tra due gas a P e T costanti: da / db = Pma / Pmb
L. di Dalton: Ptot = P1 + P2 + +Pn (in una miscela la P totale = somma delle P parziali dei singoli gas)
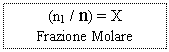 P Parziale: P1
= (n1 / n Ptot dove: n1= moli di un
componente
P Parziale: P1
= (n1 / n Ptot dove: n1= moli di un
componente
n = moli tot. della miscela
P1 = P (v1 / V) dove: v1= volume che il componente occuperebbe da solo a P e T
V = volume della miscela a P e T, somma dei volumi parziali
[Gas ¹ alle stesse condizioni hanno = n || 1 mole di qualsiasi gas a C.N. (P=1Atm, T=0 C) occupa V=22,4l]
Dissociazione Elettrolitica (vale anche per la D.Termica):
Data la reazione cAB Û aA + bB se si hanno inizialmente n moli di reagente, x delle quali si dissociano (grado di dissociazione a formano u particelle, all'equilibrio si otterrà:
 moli di AB iniziali = n = n
moli di AB iniziali = n = n
moli di A formate = ana = ax
![]() moli di B formate = bna = bx
moli di B formate = bna = bx
moli di AB residue = n - cna = n - cx
![]() moli tot dei soli
prodotti = nan = xn
moli tot dei soli
prodotti = nan = xn
moli totali all'equilibrio = n a n-l)]
Costante di Dissociazione: KE = (c a a) "legge di diluizione di Ostwald"
KE c a per gli elettroliti poco dissociati (a << 1)
(dove c = n/V e a = moli dissociate / moli iniziali)
![]()

Nella dissociazione di elettroliti deboli tutte le proprietà colligative (P , Keb, Kcr, p) vanno calcolate moltiplicando il
valore per il fattore di correzione: a u-l)] dove a = grado di dissociazione e u = numero di ioni formatisi

Nella dissociazione di elettroliti forti (sali, molecole ioniche) la dissociazione è totale (a=1) e le proprietà colligative (P , Keb, Kcr, p) vanno calcolate moltiplicando per il fattore di correzione: u = numero di ioni formatisi
Soluzioni:
Frazione Molare: X = n1 / n (rapporto tra moli di un componente e moli totali)
% in peso: g di soluto contenuti in 100g di soluzione Þ % = ga 100 / gtot
% in volume: ml di soluto contenuti in 100ml di soluzione Þ % = mla 100 / mltot
NB: la somma delle % in peso dei dei vari componenti è 100% ma non è sempre così per la somma delle % in volume.
Soluzioni Titolate: Ne della soluzione titolata = Ne della soluzione da titolare
(Vedi anche .9 "Titolazioni") V1 N1 = V2 N2
dove V è il volume in litri e N la normalità (=Eq/l)
 L. di Raoult: P = P a Xa + P b Xb + P c Xc +
L. di Raoult: P = P a Xa + P b Xb + P c Xc +
dove P a, P b, P c, sono le tensioni di vapore
dei componenti puri A, B, C, a quella T e
Xa, Xb, Xc, sono le rispettive frazioni molari.
Si ha inoltre:
Þ P - P / P = Xb P = Tens. di vapore solvente puro; Xb = fraz. Mol. Soluto non volatile
Þ P - P / P = gb Pma / ga Pmb per soluzioni diluite; ga = grammi solvente puro
Þ Pmb = (P gb Pma) / (DP ga) Pmb = peso molecolare soluto
![]() Innalz.
Ebullioscopico ed Abbass. Crioscopico: Dt = Keb m
Innalz.
Ebullioscopico ed Abbass. Crioscopico: Dt = Keb m
m = molalità Dt = Kcr m
Dt = differenza tra il punto di ebollizione o congelamento della soluzione e quello del solvente puro
Presione Osmotica: p = c R T dove: C = n / V ovvero la concentrazione in moli/litro
se V è in litri e R = 0,0821 la pressione osmotica p verrà espressa in Atm
![]()
Equilibri di Solubilità: Absolido Û nA+ + nB-
Prodotto di Solubilità: KS = costante = [A+]n [B-]n (di un elettrolita forte poco solubile)
KS = nSn nSn dove S = Solubilità (Moli/Litro)
Effetto dello Ione Comune:
considerando che:
esempio: AgCl(s) Û pAg+ + qCl- [Ag+]
= S + C
AgNO3 Û Ag+ + NO3- [Cl-] = S
avremo: KS = Sq (C + S)p da cui, quando C >> S: KS SC
![]()
Solubilità dei Gas nei Liquidi
Legge di Henry: S = cost P dove P = Pressione Parziale del Gas, il valore cost dipende da T
VG/VL = cost RT dove VG = Volume del Gas e VL = Volume del Liquido
![]()
Costante di Equilibrio
data la reazione nA + nB Û nC + nD avremo:
[C]n
[D]n [A]n
[B]n

![]() KC valida per reazioni
in fase gassosa o in soluzione
KC valida per reazioni
in fase gassosa o in soluzione
dove [x] = concentrazione molare del reagente x
XCn
XDn XAn
XBn
![]() KX valida per reazioni
in fase gassosa o in soluzione
KX valida per reazioni
in fase gassosa o in soluzione
dove X = frazione molare = moli componente / moli miscela
PCn
PDn PAn
PBn

![]() KP valida solo per reazioni in fase gassosa
KP valida solo per reazioni in fase gassosa
dove PX = pressione parziale del componente x
Ptot
XCn
Ptot XDn Ptot
XAn
Ptot XBn
![]() KP valida solo per reazioni in fase gassosa
KP valida solo per reazioni in fase gassosa
dove X = frazione molare = moli componente / moli miscela
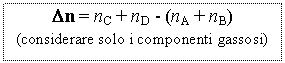 KP = KC (R T)Dn se Dn = 0 Þ KP = KC
KP = KC (R T)Dn se Dn = 0 Þ KP = KC
KP = KX PtotDn se Dn = 0 Þ KP = KX
Idrolisi salina
data la molecola ionica AB e la reazione: AB + H2O Û HB + A+ + OH-
avremo la reazione di idrolisi: B + H2O Û HB + OH- poiché A di fatto non ha reagito
Grado di Idrolisi: b (Ki/C) (è dell'ordine di 10-2 - 10-3)
[HB]
[OH-] [B]
![]() Costante di Idrolisi Ki =
Costante di Idrolisi Ki =
o anche: Ki = Kw/Kdebole per un sale proveniente da un costituente debole (acido o base) Ki = Kw/(Ka Kb) per un sale proveniente da acido e base entrambi deboli.
Termodinamica
Energia Libera: G = H - T S DG DH - T DS dove H = Entalpia e S = Entropia
per DG < 0 Þ la reazione è spontanea (esotermica)
per DG = 0 Þ la reazione è all'equilibrio
per DG > 0 Þ la reazione non è spontanea (endotermica)
![]() En. Libera
Standard: DG = - R T ln K* = -2,30 R T log10 K*
En. Libera
Standard: DG = - R T ln K* = -2,30 R T log10 K*
Equazione di Van't Hoff: log(Kp1/ Kp2) = -(DH /2,3R) (1/T1-l/T2) con: T1>T2
Equazione di Boltzman: NE=N e -E/RT dove NE = numero di molecole con energia ³E sulle N presenti
Equazione di Clapeiron: dP/dT=DH/TDV ovvero log P2/ P1=(DH/2,303R)(1/T1-l/T2)
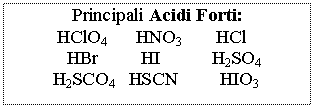
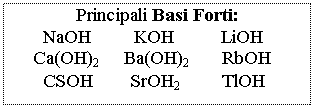
Acidi e Basi pH = - log [H+] [H+] = 10-pH
pOH = - log [OH-] [OH-] = 10-pOH
pH + pOH = 14 Þ pH = 14 - pOH e pOH = 14 - pH
![]() acidi e basi Monoprotici Þ M = N
"
v:shapes="_x0000_s1142">
acidi e basi Monoprotici Þ M = N
"
v:shapes="_x0000_s1142">
 Soluzioni di Acidi e
Basi Forti
Soluzioni di Acidi e
Basi Forti
solo per i poliprotici: pH = - log 2c
pH
= - log c se c > 10-6 M
[H+]2 - c [H+] - KW = 0 se c < 10-6 M
![]() Soluzioni di Acidi Monoprotici Deboli: HA + H2O Û H3O+
+ A-
Soluzioni di Acidi Monoprotici Deboli: HA + H2O Û H3O+
+ A-
[H+] = ( Ka c ) quando Ka < 10-3 o c > 10-3
[H+]2 + Ka [H+] - c Ka = 0 quando Ka > 10-3 o c < 10-3
qualora fosse noto a Þ [H+] = a c e pH = - log a c
Soluzioni di Basi Monoprotiche Deboli: B + H2O Û BH+ + OH-
![]() [OH-] = ( Kb c ) quando Kb < 10-3 e c
> 10-3
[OH-] = ( Kb c ) quando Kb < 10-3 e c
> 10-3
[OH-]2 + Kb [OH-] - c Kb = 0 quando Kb > 10-3 e c < 10-3
qualora fosse noto a Þ [OH-] = a c e pOH = - log a c
 Soluzioni di Acidi
Poliprotici Deboli
Soluzioni di Acidi
Poliprotici Deboli
[H+] c quando Ka < 10-3
[H+]2 + Ka [H+] - c Ka = 0 quando Ka > 10-3
Soluzioni Tamponanti (quando ho in soluzione un sale + il suo componente debole)
Acido Debole + suo Sale: [H+] = Ka (ca / cs) pH = - log Ka + log (cs / ca)
Base Debole + suo Sale: [OH-] = Kb (cb / cs) pOH = - log Kb + log (cs / cb)
Miscela di Sali di Acido Polibasico: [H+] = Ka (c1 / c2) pH = - log Ka + log (c2 / c1)
( c1 = concentrazione acido di I ionizzazione c2 = concentrazione. acido di II ionizzazione )
Equilibri Acido-Base in Soluzioni Saline (quando metto sale in acqua)
![]() sale di Acido Forte +
Base Forte Þ PH = 7 (soluz.
neutra)
sale di Acido Forte +
Base Forte Þ PH = 7 (soluz.
neutra)
sale di Acido Debole + Base Forte Þ Kb = KW / Ka [OH-] = ( Kb c ) (soluz. basica)
![]()
![]() sale di Acido Forte +
Base Debole Þ Ka = KW / Kb [H+] = ( Ka c ) (soluz. acida)
sale di Acido Forte +
Base Debole Þ Ka = KW / Kb [H+] = ( Ka c ) (soluz. acida)
sale di Acido Debole + Base Debole Þ [H+] = [KW (Ka / Kb)] ; PH = 7 ½ log Ka + ½ log Kb
![]() sali di Acidi Poliprotici ed altri Anfoliti Þ [H+] = [ Ka1 (Ka2 c + KW) / (Ka1
+ c) ]
sali di Acidi Poliprotici ed altri Anfoliti Þ [H+] = [ Ka1 (Ka2 c + KW) / (Ka1
+ c) ]

 Titolazioni: vedi
.6 "Soluzioni Þ Titolate"
Titolazioni: vedi
.6 "Soluzioni Þ Titolate"
Indicatori: HInd Û H+ + Ind-
log ( [Ind-] / [HInd] ) = pH + log Kind
Reazioni di Ossidoriduzione: "ricetta della sora Lella"

Riscrivere l'equazione molecolare in forma ionica (si dissocino tutti gli elettroliti, negli acidi si separino gli H dall'ossianione, nelle basi si separi il metallo dall'OH)
si osservi quali elementi cambiano il numero di ossidazione.
si scriva la semireazione di ciascuno di questi elementi sommando l'opportuno numero di elettroni all'elemento più positivo per colmare la differenza con l'altro
si bilancino le cariche e le masse: la somma algebrica delle cariche di destra deve eguagliare quella delle cariche di sinistra; a destra e a sinistra devono trovarsi le stesse quantità degli stessi elementi
si scriva a fianco di ciascuna semireazione il numero di elettroni che è in gioco nell'altra. Questo numero verrà usato come fattore di moltiplicazione per tutti gli elettroliti di quella semireazione.
si riscriva dunque l'equazione ionica sommando membro a membro le due semireazioni. Nel far ciò si dovrà anche moltiplicare il coefficiente stechiometrico di ciascuno ione per il fattore che gli era stato assegnato.
tralasciando gli elettroni, si ricompongano ora tutti gli elettroliti per riformare tutti i composti che si avevano inizialmente con il coefficiente che ne deriva. Si eliminino le quantità uguali di composti uguali eventualmente presenti in entrambi i membri della reazione. L'equazione molecolare è ora bilanciata.
Elettrolisi:
L. di Faraday: m = (Q PEq) / F dove: m = massa in g della sostanza formatasi
Q = quantità di elettricità (I t)
PEq = peso equivalente
F = costante di Faraday = 96500 Coulomb = 26,80 Ah
Pila Chimica Elettrodo | Ox; Rid || Ox; Rid | Elettrodo
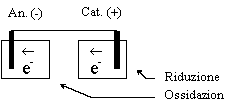 Semireazione: pox +
ne- Û qrid
Semireazione: pox +
ne- Û qrid
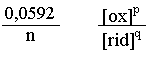 Eq. Nernst: EX = E log
Eq. Nernst: EX = E log
Regoletta
fondamentale
f.e.m. = EC - EA con: EC
> EA
OX = specie ossidante =
specie ridotta = specie che acquista elettroni = specie con maggior numero di ossidazione RID = specie riducente =
specie ossidata = specie che cede elettroni = specie con minor numero di ossidazione

Pila a Concentrazione Me | Men c || Men c' | Me
Regola
del cavolo C1p C2p
Pila
dove i semielementi sono uguali ma le concentrazioni diverse
dove: C1
> C2 Se la DC è nella specie OX Þ la specie con C=max è al catodo Se la DC è nella specie RID Þ la specie con C=min è al catodo n
![]()
![]() f.e.m = log
f.e.m = log
In generale nelle Pile:
F
= Kfaraday = 96500 Coulomb = 26,8 Ah n
= numero di elettroni scambiati E = Ec - Ea =
differenza tra i potenziali normali
DG = - n F E dove:
log K = 16,9 n E a 25 C
se DG < 0 Þ la reazione è spontanea Þ esiste una f.e.m.
![]()
"FantaChimica" = chimica empirica appositamente studiata per risolvere i problemi in modo rapido e meccanico senza troppi perché. Le regole fantachimiche sono qui riportate entro riquadri a tratto intero. Si rende noto che le leggi della Fantachimica, pur portando a risultati corretti, sono malviste dal corpo docente. Si declina ogni responsabilità circa gli effetti diseducativi, le reazioni negative degli insegnanti e gli eventuali errori causati dall'uso scorretto, arbitrario o non ponderato delle suddette leggi.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta