| chimica |
|
IL CONCETTO DI SEMIREAZIONE.
L'aspetto più significativo delle reazioni redox è che possono essere condotto con i reagenti separati nello spazio e connessi solo da un conduttore elettrico.
Si consideri la cella galvanica di ura
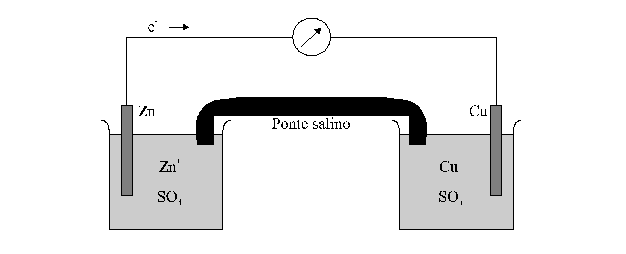
che implica la reazione fra zinco metallico e ione rame:
![]()
La cella è formata da due bicchieri, uno dei quali contiene una soluzione di un sale di Cu e una bacchetta di rame, e l'altro una soluzione di un sale di Zn e una bacchetta di zinco. I due contenitori sono connessi con un ponte salino, un tubo contenente una soluzione elettrolita, in genere una soluzione acquosa di KCl, che ne assicura il contatto elettrico tra le due soluzioni ma ne ostacola il mescolamento per diffusione degli ioni. Quando le due bacchette sono collegate ad un amperometro si ha immediata evidenza di una reazione chimica. La bacchetta di zinco inizia a passare in soluzione e il rame metallico si deposita sulla bacchetta di rame. La soluzione Zn2+ diventa più concentrata e la soluzione di Cu2 si diluisce. L'amperometro indica che c'è un flusso di elettroni dallo zinco al rame. La reazione continua fino a che la connessione o il ponte salino non vengono rimossi e fino a che è diversa da zero la concentrazione di tutti i reagenti.
Si analizzi ora, più attentamente cosa avviene nei bicchieri. Si ha evidenza che gli elettroni fluiscono dalla bacchetta di zinco a quella di rame nel circuito esterno e che gli ioni zinco si formano man mano che la bacchetta si discioglie. Queste osservazioni possono essere espresse scrivendo:
![]()
Inoltre si nota che gli elettroni fluiscono sulla bacchetta di rame, che il numero di ioni rame in soluzione diminuisce e che il rame metallico si deposita:
![]()
Bisogna a questo punto considerare a cosa serve il ponte salino. Poiché gli ioni zinco si formano man mano che gli elettroni lasciano l'elettrodo di zinco, si ha un processo che tende a produrre una carica totale positiva nel bicchiere di sinistra. Similmente l'arrivo di elettroni all'elettrodo di rame e la loro reazione con ioni rame, tende a produrre una carica netta negativa nel bicchiere di destra. Il ponte salino evita un accumulo di ioni o cariche in ognuno dei bicchieri permettendo agli ioni negativi di abbandonare il bicchiere di destra e passare in quello di sinistra, diffondendo attraverso il ponte. Contemporaneamente ci può essere una diffusione di ioni positivi da sinistra a destra. Se non avvenisse la migrazione di ioni per diffusione, l'accumulo di carica impedirebbe il flusso di elettroni attraverso il circuito esterno e la reazione si fermerebbe: tale passaggio è necessario per assicurare la neutralità elettrica delle soluzioni delle due semicelle e il funzionamento della pila.
Anche se il sale non prende parte alla reazione chimica nella cella, esso deve essere presente perché la cella possa funzionare.
L'analisi di questa cella suggerisce che la reazione redox globale può essere separata in due semi-reazioni:
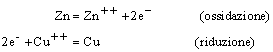
![]()
Molte altre reazioni redox possono essere condotte con successo in celle galvaniche ed è naturale pensare a questi processi come a semi-reazioni che avvengono ai due elettrodi. Pertanto ogni reazione redox che avvenga in qualsiasi condizione può essere separata concettualmente di due semi-reazioni.
I vantaggi sono:
a) Le semi-reazioni possono essere molto utili nel bilancio delle equazioni redox.
b) Le semi-reazioni costituiscono lo strumento di azione della forza di agenti ossidanti e riducenti.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta