| chimica |
|
Relazione di Chimica
Mercoledì 15/12/04, presso il laboratorio di fisica della scuola Federico II di Apricena, abbiamo effettuato due esperienze per verificare due importanti leggi dei gas: la legge di Charles e la legge di Boyle. Per entrambi gli esperimenti è stata presa l'aria come gas su cui effettuare le esperienze.
Obiettivo: verificare la legge di Charles (o isobara)
Strumenti e materiali: due basi con asta, morsetti, pinze, siringa di plastica da 60 ml (raggio
Per verificare la legge di Charles, legge riguardante i gas a pressione
costante, perciò detta isobara, la quale dice che l'aumento di
temperatura di un gas è direttamente proporzionale al suo volume,
abbiamo preso due basi con asta metallica e applicato ad entrambe un morsetto,
abbiamo inserito poi in entrambi i morsetti un'altra asta metallica e ad
entrambe queste abbiamo applicato una pinza. Abbiamo preso una siringa da 60 ml
e con un calibro ne abbiamo misurato il diametro (28.8mm) e quindi il raggio.
Poi con un tappo di gomma, dopo aver tirato il pistone fino a 30 ml per far
entrare l'aria, abbiamo chiuso l'estremità della siringa e l'abbiamo
inserita in una delle due pinze. Lo stesso abbiamo fatto con un termometro con
la differenza che il tappo lo abbiamo fatto scorrere fino alla metà
dello stesso in modo tale che la pinza dove poi è stato inserito
stringesse il tappo e non direttamente il termometro che altrimenti si sarebbe
rotto. Abbiamo posizionato un bicchiere sotto la siringa e al suo interno, oltre alla siringa stessa,
abbiamo inserito anche il termometro e vi abbiamo versato 500 ml di acqua di
rubinetto a temperatura ambiente e, dopo aver misurato la temperatura che era
|
|
Volume aria in mm3 |
Volume aria inL |
Temperatura in °C |
Temperatura in K |
Altezza pistone in mm |
|
V1 |
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
V3 |
|
|
|
|
|
|
V4 |
|
|
|
|
|
Svolgimento dei calcoli
Per lo svolgimento dei calcoli abbiamo innanzitutto calcolato l'area di base della siringa, che essendo un cerchio si calcola con la formula A = π . r2 :
r =
Ab = (
Poi per calcolare il volume in mm3 abbiamo applicato la formula del volume del cilindro, essendo la siringa un cilindro, appunto. V = Ab . h, dove h indica l'altezza raggiunta dal pistone:
V1 = 651 mm2 .
V2 = 651 mm2 .
V3 = 651 mm2 .
V4 = 651 mm2 .
Effettuando poi l'equivalenza tra mm3 e dm3 e poi tra dm3 e l otteniamo i valori del volume espressi in l che sono stati riportati in tabella.
Rappresentando i valori della temperatura in K e il volume in l sul piano sectiunesiano, i punti definiscono una linea quasi retta, questo perché i valori del volume sono direttamente proporzionali a quelli della temperatura, come è detto nella legge stessa e come si può vedere dai calcoli. La linea non è perfettamente retta perché, come in qualsiasi esperimento, sono presenti degli errori sistematici e accidentali che hanno influito sui valori delle misure ed è inoltre impossibile effettuare l'estrapolazione.
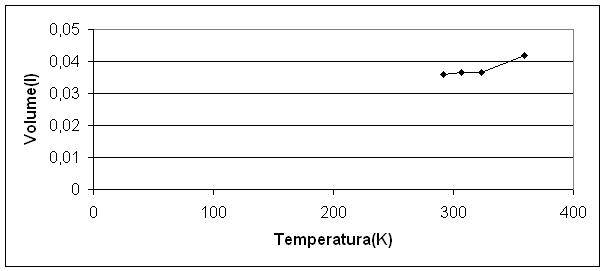
Calcolando i valori che dovevamo ottenere realmente tramite l'equazione V1/T1=V2/T2, da cui si ricava la formula V2= V1.T2/T1 e rappresentandoli sul grafico otteniamo invece una linea retta:
V1 = (
V2 = (
V3 = (
V4 = (
Quindi otteniamo la seguente tabella i cui valori sono riportati nel grafico:
|
Temperatura in K |
Volume in l |
|
|
|
|
|
|
|
|
|
|
|
|
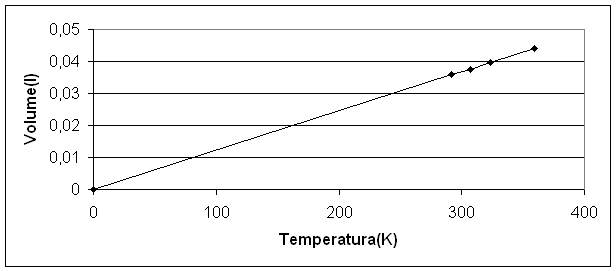
Grazie a questo grafico è possibile dimostrare come tra le grandezze volume e temperatura ci sia un rapporto di proporzionalità diretta. Effettuando l'estrapolazione grafica si può vedere anche come la retta intersechi l'asse delle temperature nel valore 0 e come questo corrisponda al valore 0 del volume: ad una temperatura di 0 K (che viene detta zero assoluto) il volume assume un valore nullo.
Obiettivo: verificare la legge di Boyle (o isoterma)
Strumenti e materiali: una siringa di plastica da 60 ml (raggio 14.4mm); base con asta metallica, morsetto, pinza, tappo di gomma, mattoncini di marmo (di peso superiore al kg), aria.
Per verificare la legge di Boyle, legge riguardante i gas a temperatura
costante, perciò detta isoterma, la quale dice che il volume di un
qualsiasi gas ideale che si trova a temperatura costante è inversamente
proporzionale alla pressione, abbiamo preso la base con asta metallica e vi
abbiamo collegato il morsetto. Al morsetto abbiamo collegato un'altra asta
metallica alla cui estremità era attaccata una pinza e all'interno di
questa abbiamo inserito la siringa con la quale abbiamo aspirato dell'aria
tirando il pistone, fino a quando questo non aveva raggiunto un'altezza di
A questo punto, con il tappo di gomma,
abbiamo chiuso l'estremità della siringa per non far uscire l'aria e
l'abbiamo abbassata fino a quando il tappo è arrivato a toccare la base
dell'asta. Successivamente, abbiamo poggiato un mattone di marmo sul pistone
della siringa e abbiamo visto che il pistone si è portato da un altezza
di 55mm a una di 45mm. Abbiamo poi aggiunto altri 3 mattoni su quello
precedente, e il pistone ad ogni mattone si è abbassato, portandosi a 39, 34 e
Svolgimento dei calcoli
Effettuando gli opportuni calcoli possiamo
sapere il volume dell'aria cui corrispondono i 55, 45, 39, 34 e
Siccome la siringa è un cilindro il suo volume si calcola facendo il prodotto tra l'area di base e l'altezza, in questo caso quella del pistone. L'area di base di un cilindro si calcola applicando la formula dell'area del cerchio:
Ab = (
Quindi l'area di base è pari a 651mm2; moltiplicando questo valore per quello delle varie altezze otteniamo V0, V1, V2, V3 e V4, cioè i valori dei volumi in mm3:
V0 = 651 mm2 .
V1 = 651 mm2 .
V2 = 651 mm2 .
V3 = 651 mm2 .
V4 = 651 mm2 .
Effettuando l'equivalenza tra mm3 e dm3 e tra dm3 e l si ottengono i valori del volume in l riportati nella tabella che segue.
Per calcolare la pressione invece utilizziamo la formula P1= (P0 . V0)/ V1 derivante dall'equazione della legge di Boyle P0.V0=P1.V1:
P0= 1atm
P1= (1atm .
P2= (1atm .
P3= (1atm .
P4= (1atm .
|
Numero mattoni di marmo |
h pistone (mm) |
Volume (l) |
pressione (atm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Quanto detto fin ora può essere riassunto nella seguente tabella:
Riportando in ascissa i valori del volume e in ordinata quelli della pressione, è inoltre possibile disegnare il grafico dell'esperimento:
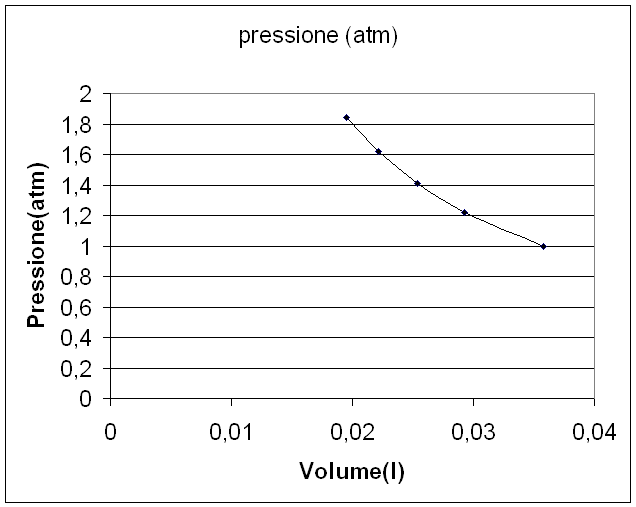
come si può vedere, il grafico risultante è un ramo di iperbole equilatera, questo perché, come è detto nella legge di Boyle e come si può vedere dai risultati dei calcoli, la pressione è inversamente proporzionale al volume , cioè all'aumentare dei valori dell'una , diminuiscono i valori dell'altro.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta