| chimica |
|
Problemi risolti
A) Determinare la costante di Henry per l'acido cloridrico in acqua a 0 °C, sapendo che dopo aver saturato dell'acqua facendovi gorgogliare HCl alla pressione di 1 atm si ottiene una soluzione avente densità 1,12 g/ml, 35 ml della quale reagiscono completamente con 109 ml di NaOH 3 M. Calcolare inoltre la percentuale in peso C(p/p) della soluzione ottenuta.
ricordando la relazione 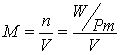 possiamo calcolare che 109 ml di NaOH
0,3 M contengono
possiamo calcolare che 109 ml di NaOH
0,3 M contengono
![]() di NaOH
di NaOH
Poichè l'acido cloridrico reagisce con l'idrossido di sodio nelle proporzioni molari di 1/1 secondo la reazione HCl + NaOH à NaCl + H2O possiamo calcolare quanti grammi di HCl hanno reagito con 13,08 g di NaOH mediante la seguente proporzione
![]()
da cui
![]()
Sono dunque presenti 11,94 g di HCl in 35 ml di soluzione. In un litro di soluzione saranno quindi presenti
![]()
Poichè la densità della soluzione è 1,12 g/ml, 1 litro di soluzione peserà 1120 g, di cui 341 g di HCl e 779 g di acqua.
341 g di acido cloridrico corrispondono a W/Pm = 341/36,5 = 9,34 moli
Si sono dunque sciolte 9,34 moli di acido cloridrico in 779 g di acqua (779 ml essendo la densità dell'acqua pari a 1 g/ml).
Calcoliamo quante moli si sono sciolte in un litro di acqua
![]()
Poichè il processo è avvenuto alla pressione di 1 atmosfera tale valore rappresenta proprio la costante di Henry cercata, la quale vale KH = 12 mol l-l atm-l.
Calcoliamo infine la percentuale in peso della soluzione acida ottenuta
![]()
Problemi da risolvere
1. Se la costante di Henry per l'azoto in acqua a 0°C vale 1,036*10-3 mol l-l atm-l, calcolare quanti g di N2 si sciolgono in 200 ml di acqua a 5 atmosfere e 0°C.
2. A 20°C la costante di Henry per l'azoto e l'ossigeno in acqua vale rispettivamente 6,786*10-4 mol/l atm e 1,345*10-3 mol/l atm. Calcolare quanti grammi dei due gas si sciolgono in acqua esposta all'aria a pressione di 760 mm di Hg, supponendo che l'aria sia composta per il 21% (c oss) di O2 e per il 79% (c az) di N2.
3. Una miscela gassosa ad una pressione di 2,5 atm è costituita dal 70% (c idr) di idrogeno e dal 30% (c oss) di ossigeno. Sapendo che a 20°C si sciolgono 35,8 ml di idrogeno per litro, calcolare la costante di Henry per l'idrogeno in acqua a 20°C.
4. Sapendo che un litro di CO2 gassosa a 15°C e ad una atmosfera si scioglie in un litro di acqua. Calcolare la molalità della CO2 in una soluzione a contatto con anidride carbonica alla pressione parziale di 150 mm di Hg. Determinare inoltre il valore della costante di Henry per la CO2 in acqua a 15°C.
RISOLUZIONI
1. 2,9.10-2 g
2. O2] = 9.10-3 g/l [N2] = 1,5.10-2 g/l
3. 8 -4 mol/l atm
4. 8 -3 mol/l K = 4,2.10-2 mol/l atm
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta