| chimica |
|
PROPRIETà COLLIGATIVE DELLE SOLUZIONI.
Si intende per proprietà colligative di una soluzione le proprietà che dipendono solo dal numero di particelle (molecole) presenti in soluzione.
Ebullioscopia e crioscopia
La variazione della pressione di vapore è accomnata da variazioni di altre proprietà quali il punto di ebollizione ed il punto di congelamento. L'andamento qualitativo di tali variazioni può essere dedotto dal diagramma di stato del solvente. Si riporta a tal fine sullo stesso grafico il diagramma di stato di un solvente puro e quello di una soluzione costituita da tale solvente e da uno o più soluti non volatili.
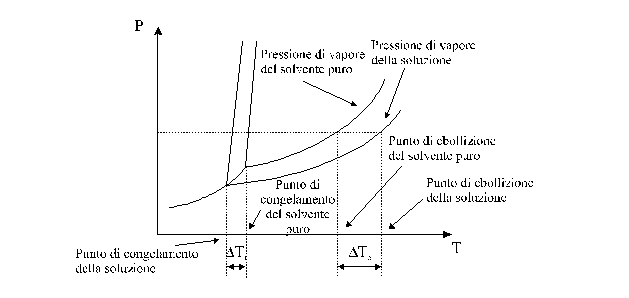
Si vede quindi come una aumento della concentrazione del soluto aumenta l'abbassamento del punto di solidificazione e l'innalzamento del punto di ebollizione.
D'altra parte, tale effetto poteva essere evidenziato osservando che in una qualunque soluzione in cui i soluti sono non volatili, la tensione di vapore della soluzione P è uguale a quella del solvente p1, essendo il vapore in equilibrio con la soluzione
![]()
dove x1 e DHv sono rispettivamente la frazione molare e l'entalpia di evaporazione del solvente.
Ad ogni temperatura la tensione di vapore P della soluzione è minore di quella p1° del solvente puro (x1<1). Poiché la temperatura di ebollizione Te è la temperatura alla quale la tensione di vapore è uguale alla pressione atmosferica, l'abbassamento della tensione di vapore dovuto alla presenza del soluto fa sì che, affinché si ristabilisca l'equilibrio la tensione di vapore della soluzione eguagli nuovamente la pressione atmosferica. Ciò può ottenersi solo con un aumento di temperatura. Pertanto la temperatura di ebollizione della soluzione è maggiore di quella del solvente puro. Analogo discorso vale per la temperatura di fusione o di congelamento Tf, per cui si verifica che la temperatura di congelamento della soluzione è minore di quella del solvente puro.
Esperimenti effettuati su un gran numero di soluzioni, hanno permesso di ricavare delle relazioni quantitative fra le variazioni delle temperature di solidificazione ed ebollizione e la concentrazione del soluto. Le relazioni in questione assumono una forma molto semplice se la concentrazione del soluto viene espressa in molalità. Si ha rispettivamente per l'abbassamento del punto di gelo (abbassamento crioscopico) e l'innalzamento del punto di ebollizione (innalzamento ebullioscopico):
![]()
ove m rappresenta la molalità del soluto.
Le due costanti Kf (costante crioscopica) e Ke (costante ebullioscopica) rappresentano rispettivamente l'abbassamento crioscopico e l'innalzamento ebullioscopico di una soluzione di molalità unitaria di un qualsiasi soluto in quel solvente. I valori di Kf e Ke dipendono dalla natura del solvente, poiché dipendono dal suo peso molecolare, dalla sua temperatura di ebollizione o di solidificazione e dalla sua entalpia di evaporazione o di sublimazione, mentre sono costanti rispetto alla natura del soluto, alla temperatura ed alla concentrazione del soluto. Va osservato che la costanza rispetto alla concentrazione è vera sempre che si abbia a che fare con soluzioni ideali.
Curve di raffreddamento
|
|
Si è visto che la presenza di un soluto ha l'effetto di abbassare il punto di congelamento del solvente. La solidificazione di una parte del solvente fa si che la soluzione, in equilibrio con il solvente solido, si concentri. Se continuiamo a sottrarre calore al sistema abbiamo la solidificazione di altro solvente, ma la solidificazione avviene a una temperatura più bassa del punto di solidificazione iniziale. Questo comportamento è illustrato dalla ura qui a lato in cui si sono riportate le curve di raffreddamento di un liquido puro e di una soluzione avente tale liquido come solvente.
Si ha la seguente situazione.
Per il liquido puro, la temperatura si abbassa fino al suo punto di solidificazione Tf e quindi resta costante fino a che tutto il liquido non ha solidificato per poi riprendere a diminuire.
Per la soluzione, la temperatura si abbassa fino alla temperatura Tf' alla quale inizia a solidificare il solvente (il DTf è quello che abbiamo imparato a calcolare). La temperatura della soluzione, però, non si arresta perché solidificando il solvente, la concentrazione m del soluto aumenta e con essa aumenta il DTf. La temperatura della soluzione continua quindi ancora ad abbassarsi fino alla temperatura Tf*, detta temperatura eutettica e caratteristica della coppia soluto-solvente, con una pendenza minore per effetto del calore sviluppato dalla solidificazione del solvente (calore latente di solidificazione). Giunta alla temperatura Tf*, la soluzione è diventata satura, la concentrazione m del soluto e quindi il DTf non possono più aumentare. Un'ulteriore solidificazione del solvente comporta una precipitazione del soluto. La temperatura della soluzione resterà quindi costante fino alla completa solidificazione della soluzione.
Pertanto, le soluzioni non hanno un punto di solidificazione Tf come i liquidi puri, ma un intervallo Tf - Tf* di solidificazione.
L'uso del sale sulle strade ghiacciate costituisce una applicazione dell'abbassamento del punto di gelo delle soluzioni. Aggiungendo sale al ghiaccio, quest'ultimo fonde perché si origina una soluzione il cui punto di gelo è più basso della temperatura del ghiaccio, a patto che questa non sia inferiore a -21°C Tf* per la soluzione NaCl - H2O).
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta