| chimica |
|
SINTESI DELL'ASPIRINA
- Scopo dell'esperienza è arrivare alla sintesi di acido acetilsalicilico realizzandone l'isolamento e la purificazione attraverso lo sfruttamento della reattività specifica di un gruppo funzionale, mostrando come piccole variazioni strutturali comportino specifiche chimico-fisiche tali da rendere possibili separazione efficaci di composti anche solo leggermente diversi.
- Il principio attivo dell'aspirina, l'acido acetilsalicilico, è un composto farmacologico relativamente "antico"; Le foglie e la corteccia di salice contenenti forme chimiche affini all'attuale aspirina venivano infatti sfruttate già da sumeri e egizi, per le loro proprietà analgesiche e antipiretiche. L'aspirina agisce acetilando e inibendo irreversibilmente l'enzima cicloossigenasi, coinvolto nella sintesi di prostaglandine (che modulano la trasmissione dei segnali del dolore a livello cefalico e la regolazione della temperatura corporea a livello dell'ipotalamo) e di trombossani (responsabili dell'aggregazione delle piastrine e quindi della formazione di coaguli di sangue).
- La prima estrazione di tale sostanza attiva avviene nel 1828: il farmacista francese Leroux e il chimico italiano Piria estraggono dalla corteccia di Salix Alba la Salicina, che in virtù del suo pH 2,4 in soluzione satura viene ribattezzata Acido Salicilico.
- Tale molecola risulta però fortemente irritante per le mucose e nel 1897 dei chimici del gruppo Bayer riescono nell'intento di ottenere un derivato che, pur mantenendone le proprietà chimiche utili alla farmacologia, limiti la propria azione nociva. Per far ciò si sfruttò il gruppo ossidrile, posto sul fenile, della molecola di acido salicilico, derivandolo tramite esterificazione in presenza di anidride acetica e ottenendo quindi una acetilazione di tale gruppo funzionale; la molecola ottenuta, il primo farmaco sintetico mai realizzato, è quindi detta Acido Acetilsalicilico o più comunemente Aspirina.
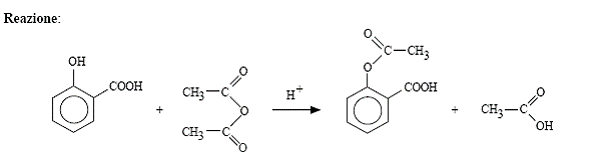
Acido Salicilico Anidride Acetica Acido Acetilsalicilico Acido Acetico
- Una volta ottenuta tale molecola andremo a effettuare diverse procedure di purificazione tra cui la filtrazione , la cristallizzazione e l'essiccamento; Alla fine di tali processi valuteremo la resa qualitativa (purezza del composto ottenuto) e quantitativa (rapporto tra le moli iniziali e finali di prodotto, idealmente di 1:1).
PROCEDIMENTO
- Lavorando sotto cappa, poniamo in una beuta da 100ml acido salicilico in quantità di 5gr cui aggiungiamo tramite cilindro graduato 7ml di anidride acetica. La reazione di esterificazione che vogliamo realizzare è acido-catalizzata e aggiungiamo quindi lentamente 5 gocce di acido solforico concentrato. Per velocizzare la reazione scaldiamo in un bagno d'acqua a 60° C circa, agitando lentamente e impedendo l'evaporazione dell'anidride acetica con un foglio di carta da filtro sopra il recipiente; Anche tale operazione viene svolta sotto cappa, e prolungata fino alla completa dissoluzione del solido. Quello che otteniamo è una soluzione più o meno mista, nella quale sono presenti contemporaneamente acido salicilico, acido acetilsalicilico, acido acetico e acido solforico; sarà quindi necessario ricorrere a metodi di purificazione per separare al meglio le sostanze presenti.
- Aggiungiamo 70ml di acqua alla nostra beuta e lasciamo raffreddare sempre mescolando con la bacchetta, fino a ottenere un precipitato macroscopicamente apprezzabile. Effettuiamo quindi una prima filtrazione, utilizzando un imbuto di Büchner opportunamente corredato di carta da filtro; collegato a una pompa ad acqua che crei il vuoto, questi filtra la soluzione ottenuta trattenendo più o meno efficacemente i cristalli presenti che rimangono intrappolati nell'imbuto mentre la parte liquida percola senza problemi. Se la soluzione rimane troppo torbida ripetiamo l'operazione effettuando filtrazioni successive, fino a ottenere con buona approssimazione tutto il precipitato che era presente.
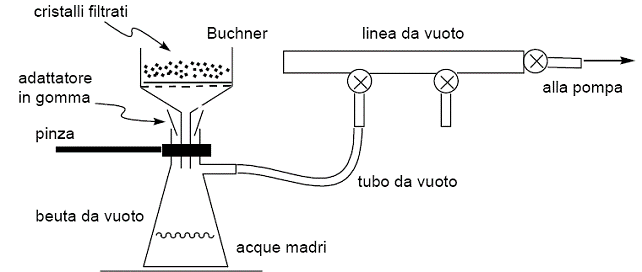
- Siamo però ancora in presenza sia di acido acetilsalicilico che di acido salicilico, che è necessario separare; per far ciò sfruttiamo il fatto che nella esterificazione da una all'altra molecola la polarità è cambiata, e con questa la solubilità in un solvente più o meno polare. Il processo di purificazione che sfrutta tali diverse affinità di solubilizzazione è detto cristallizzazione, che andremo a effettuare sul nostro composto.
- Trasferiamo il precipitato in una beuta da 100ml, cui aggiungiamo 15ml di etanolo e forniamo quindi calore (sulla piastra riscaldante) fino a completa solubilizzazione di tutto il precipitato. Andiamo ora a aggiungere 40ml di acqua, che è un solvente polare; raffreddando e agitando a lungo con la bacchetta, e grattando contro le pareti del becher, solamente l'acido acetilsalicilico ricristallizzerà mentre le impurità (nel nostro caso acido salicilico di partenza) rimarranno in soluzione. Abbiamo sfruttato il fatto che, a differenza delle altre specie presenti, l'acido acetilsalicilico ha una bassa solubilità in acqua dovuta al cambio di polarità post-esterificazione.
- Ancora una volta andiamo a effettuare una filtrazione su imbuto di Büchner con pompa a vuoto del precipitato ottenuto, raffinando ulteriormente il nostro composto. Allo stato attuale il precipitato ha però assorbito umidità esterna e possono in più esserci delle molecole d'acqua inglobate durante il processo di cristallizzazione: si procede quindi a una disidratazione per essiccamento, ponendo il precipitato (in un contenitore composto di carta da filtro) dentro una stufa per circa mezzora. Pesiamo il contenitore prima e dopo, per ottenere infine l'effettivo peso dell'acido acetilsalicilico ottenuto.
- A fronte di un peso iniziale di 3,50g riscontriamo un peso post-essiccamento di 6,02g ricavandone quindi che la quantità di acido acetilsalicilico sintetizzata è pari a circa 2,52g. Conoscendo il peso molecolare della molecola calcoliamo il numero di moli:
n.moli = g/PM = 2,52/180 = 0,014 mol/l Acido Acetilsalicilico
Calcoliamo ora il numero di moli iniziali, sapendo che i grammi di acido salicilico di partenza erano 5 e il peso molecolare della molecola non acetilata è 138:
n.moli = g/PM = 5/138 = 0,036 mol/l Acido Salicilico
- La resa quantitativa è data dal rapporto percentuale tra le moli di prodotti e reagenti:
RESA % = (n.moli finali/n.moli iniziali)*100 = (0,014/0,036)*100 = 39%
- L'acido salicilico di partenza ha "fruttato" quindi al 39%, cioè con una perdita abbastanza netta durante il processo di sintesi dovuta ad esempio a perdite nel travaso di precipitato, mancata precipitazione completa di tutta la specie in soluzione e così via.
- Andiamo ora a rilevare l'aspetto qualitativo del processo, cioè quanto è puro il composto ottenuto: sfruttiamo la temperatura di fusione come parametro di purezza, sapendo da tabulato che l'acido acetilsalicilico fonde decomponendosi tra 128° C e 135° C. Poniamo una piccolissima quantità del nostro prodotto finale in un apposito apparecchio, che permette di monitorare con ingrandimento il composto introdotto e aumenta gradualmente e lentamente la temperatura. Tramite osservazione costante vediamo i primi segni di fusione e decomposizione quando la temperatura registrata è 131,0° C a fronte di un range atteso 128/135; il composto ottenuto, pur essendo non eccellente a livello di resa quantitativa, risulta quindi essere discretamente puro e coerente coi parametri chimico-fisici tipici dell'acido acetilsalicilico.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta