| chimica |
|
|||||
|
TRATTAZIONE TERMODINAMICA DELL'EQUILIBRIO CHIMICO.
In chimica si incontrano spesso sistemi costituiti da più componenti in soluzione. Per lo studio delle condizioni di equilibrio in tali sistemi è utile poter determinare la quantità di energia libera associata ad una mole di ciascuno dei componenti del sistema in esame.
L'energia libera GA di una mole di un generico componente A di una soluzione dipende dalla concentrazione molare del componente stesso, che indichiamo con il simbolo [A]: ci occuperemo in prima istanza di studiare la dipendenza di GA dalla concentrazione molare [A], a una data temperatura. L'importanza di tale relazione risiede nel fatto che, essendo le condizioni di equilibrio regolate dall'energia libera, sarà possibile stabilire l'influenza delle concentrazioni sull'equilibrio in sistemi a più componenti.
Il tipo più semplice di sistema omogeneo a più componenti è costituito da una miscela di gas a comportamento ideale. In questo caso è facile trovare la relazione tra l'energia libera di una mole di un componente generico A è la sua pressione parziale PA.
Partiamo dalle relazioni generali:
![]()
Poiché l'energia libera dovuta all'interazione tra molecole nei gas ideali è nulla, l'energia interna EA dipende soltanto dall'agitazione termica delle molecole, cioè soltanto dalla temperatura. Siccome il prodotto PA V tra la pressione parziale PA ed il volume è costante ad una data temperatura, ne consegue che l'entalpia di una mole del componente A non dipende dalla pressione PA. Pertanto la dipendenza dell'energia libera di una mole di A dalla pressione PA è dovuta soltanto al termine entropico.
La variazione di SA nel passare dalla pressione P'A alla pressione P''A relativamente ad una mole del gas A è data da:
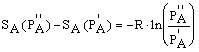
Se chiamiamo S°A l'entropia molare di A alla temperatura T=298°K=25°C ed alla pressione di una atmosfera (condizioni normali), e Sa l'entropia molare dello stesso componente alla pressione parziale PA ed alla stessa temperatura, si ha:
![]()
ossia
![]()
dove G°A=HA-T S°A rappresenta l'energia libera di una mole di A a T.P.S..
Si tratta ora di trovare una relazione tra la variazione di energia libera standard e la costante di equilibrio di una generica reazione chimica fra gas ideali.
Si consideri la generica reazione
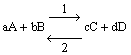
si ha:
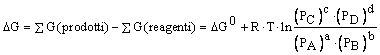
Questa è un'equazione molto importante, in quanto mette in relazione la variazione di energia libera di una qualsiasi reazione di un gas ideale a pressioni arbitrarie dei reagenti e dei prodotti, con la variazione di energia libera normale e con le pressioni dei reagenti.
Si supponga che le pressioni nell'equazione siano quelle esistenti tra reagenti e prodotti in equilibrio tra loro, allora dovrà essere DG=0, da cui:
![]()
cioè abbiamo trovato la relazione tra la variazione di energia libera normale e la costante di equilibrio. In particolare per n moli di gas potrà scriversi:
![]()
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta