| chimica |
|
Obiettivi
Determinare la concentrazione e quindi il pH di una soluzione acida.
Studiare le caratteristiche e le proprietà di acidi diversi.
Osservare i diversi comportamenti di acidi poliprotici e monoprotici se messi a reagire con soluzione basiche.
Materiale:
1 buretta (portata: 100 mL; sensibilità: ± 0.1 mL);
1 becher (portata: 100mL; sensibilità: ± 20mL);
1 agitatore
1 sostegno
Sostanze:
Acido Cloridrico (HCl).
Acido Acetico (CH3COOH).
Acido Solforico (H2SO4).
Idrossido di Sodio (NaOH 0.1 M).
Fenolftaleina.
Metilarancio.
Procedure
Preparare una soluzione a titolo noto di NaOH.
Versare tale soluzione in una buretta graduata.
Introdurre nel becker una quantità nota dell'acido che si desidera titolare.
Portare a volume aggiungendo H2O per rendere più facile la titolazione.
Aggiungere alcune gocce di indicatore per rendere percettibile il viraggio.
Agitando continuamente iniziare ad aggiungere l'NaOH all'acido dapprima grossolanamente fino ad arrivare a poco prima del presunto punto di viraggio (quando è possibile calcolarlo) e procedere aggiungendo quantità minime fino al viraggio.
Ripetere la titolazione con acidi aventi caratteristiche diverse.
Registrare i dati in un apposita tabella.
Se si dispone di un pHmetro ripetere la titolazione per stabilire con maggiore precisione il punto di viraggo e per poter costruire un grafico che rappresenti il variare del pH in funzione dell'aggiunta di NaOH.
Osservazioni:
Per questa esperienza abbiamo deciso di utilizzare due acidi monoprotici, conteneni cioè soltanto un atomo di idrogeno, ed uno piliprotico, in questo caso biprotico, come l' H2SO4, che ne contiene due.
Anche per quanto riguarda gli acidi monoprotici abbiamo fatto una distinzione, ne abbiamo usato uno forte, come l' HCl ed uno debole, come l' CH3COOH.
La differenza sostanziale sta nel fatto che gli acidi cosiddetti"forti" (HCl in questo caso) quando vengono messi in acqua idrolizzano completamente, dissociandosi in H+ e Cl-.
Gli acidi deboli invece no; durante l'idrolisi si dissocia soltanto una parte ben definita di essi.
Il rapporto tra la parte che si dissocia e quella che invece rimane integra viene chiamata costante di dissociazione acida e per l' acido acetico vale 1.8 * 10-5 il che vuol dire che se diluiamo in acqua dell'acido acetico si dissocerà soltanto una molecola ogni 1.8*105.
Questo dato è molto importante per la definizione del pH: infatti il pH è il logaritmo cambiato di seno (p) della concentrazione molare di H+à [H+].
E' anhe possibile definire il pOH di una soluzione, come il - log[OH-].
La scala del pH o del pOH ha un range che può andare da 0 a 14, infatti la somma del pH e del pOH di una sostanza da sempre come risultato 14.
Il prodotto di solubilità dell' acqua è infatti di 1.00 * 10-l4.
Se la concentrazione molare dell'acido (o della base) è maggiore di 1 mole/litro il pH dovrebbe venire inferiore a 0 o maggiore di14, ma questo in realtà non può avvenire in quanto il reagente non può più dissociarsi.
Questi sono i grafici ottenuti dalle varie titolazioni:
Acido Cloridrico: (monoprotico forte)
|
mL NaOH |
pH |
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
Acido Acetico:( monoprotico debole)
|
mL NaOH |
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
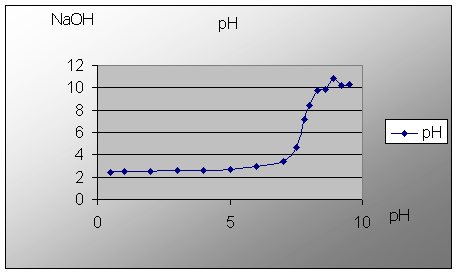
Acido solforico (biprotico)
|
mL NaOH |
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Come è visibile nel primo grafico, quello relativo all' HCl, il pH varia di poco all' aggiunta di NaOh fino alla prossimità del punto di viraggio, quando basta una minima quantità di NaOH per portare il pH circa da 3 a 10.
Nel grafico relativo all' Acido acetico questo salto, seppur abbastanza evidente è meno marcato.
Questa differenza è dovuta al fatto che in questo caso si è formata una soluzione tampone, cioè una soluzione capace di assorbire discrete quantità di acidi o basi senza modificare il pH. Genericamente si formano quando si trovano a reagire un acido debole e il suo sale con na base coniugata forte, o viceversa. L'acido acetico ha reagito con lNaOh, formando acetato do sodio. Questa soluzione è in grado di assorbire la base senza modificare il proprio pH.
Questa soluzioni sono usate in chimica generalmente per la taratura di strumenti di precisione come i pHmetri.
Nel terzo caso assistiamo alla titolazione di un acido biprotico.
Il grafico mostra due "scalini" che rappresentano il neutralizzarsi dei due idrogeni nella reazione. In questo caso abbiamo deciso di usare due indicatori diversi, la fenolftaleina, che vuira ad un pH di circa 9 e il metilarancio che invece vira ad un pH acido vicino al 4, per poter assistere meglio al doppio viraggio dell'acido.
Se avessimo utilizzato un acido con un diverso numero di idrogeni, questo salto si sarebbe verificato un numero di volte pari a quello degli idrogeni dell'acido.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta