| fisica |
|
Il ciclo
frigorifero - 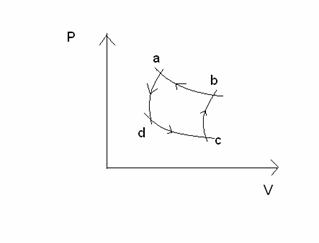 Ciclo di Carnot al contrario
Ciclo di Carnot al contrario
È il comune processo che avviene all'interno delle macchine frigorifere.
È un ciclo reversibile *: facendo il giro al contrario, tutto torna come era prima.
Per ripristinare la situazione di partenza dovremmo compiere lavoro [altrimenti andremmo contro l'enunciato di Clausius]
Dimostriamo ora il motivo per cui in un ciclo di Carnot |Qi|/|Ti| = |Qf|/|Tf| à ΔS = 0
Ciò vale in ogni ciclo reversibile termodinamico in quando ponendo tratti paralleli al percorso della trasformazione adiabatica e di quella isortemica finiremmo in un ciclo di Carnot.
definizione di rendimento di un ciclo frigorifero ή = Q assorbito / Lavoro
se blocchiamo la pressione di due termostati a contatto,accadrà mai che il termostato più alto andrà a scaldare quello più freddo e viceversa? Perché?
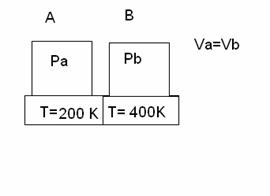
se V=k àse Ta = ½ Tb à per la legge P= Po ά T à Pa = ½ Tb
Concetto di reversibilità:
Una trasformazione reversibile di un sistema termodinamico è tale se alla fine è possibile con altre trasformazioni riportare nei rispettivi stati iniziali il sistema in questione e l'ambiente circostante (cioè l'insieme degli oggetti che agiscono direttamente sul sistema) senza modificare il resto dell'universo (cioè tutti gli altri dispositivi che, eventualmente, si possono fare interagire col sistema).
se in una trasformazione non sono rappresentabili gli stati intermedi del gas à ciclo IRREVERSIBILE:
Una trasformazione irreversibile di un sistema termodinamico, è dunque quella trasformazione che non è possibile invertire riportando il sistema dallo stato finale a quello iniziale in maniera tale che, alla fine, non solo l'ambiente in diretto contatto con il sistema, ma anche l'universo siano tornati al loro stato iniziale.
- tutte le trasformazioni che coinvolgono l energia meccanica sono reversibili, ovvero possiamo stabilire con anticipo cosa avverrà nel processo.
Per quantificare il grado di reversibilità di un processo definiamo l'entropia:
Entropia : S = Q ∕ T à S = [J/K]
l'entropia di un sistema isolato che cioè non scambia né calore né lavoro con l'esterno, non può mai diminuire. Rappresenta i gradi di reversibilità di un processo.
Siccome l'universo si considera un sistema isolato, l'entropia dell'universo è in continuo aumento.
 termostato Bà
più freddo
termostato Bà
più freddo
termostato A à più caldo
i parametri del gas rimangono invariati
Mantenendo la temperatura costante possiamo mettere tanti termostati ove la variazione Δ à 0 , cosi più è fitta la successione di termostati meno varia il lavoro per riportare il calore al proprio stato iniziale.
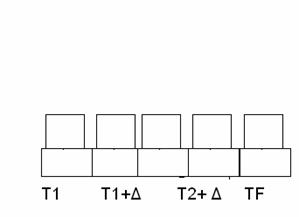 Nel caso limite L = 0.
Nel caso limite L = 0.
Altro esempio di cicloà è reversibile poiché:
gas rimane come prima
l'aumento di T è tendente allo 0 à anche il lavoro usato sarà à
Analisi di una trasformazione termodinamica costituita da una fase (a) reversibile e una (b) irreversibile che avviene in un sistema isolato che porta il gas da uno stato A a quello in B.
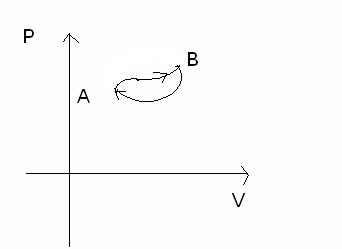
a) ΔS = 0 da A a B
à ΔS < 0
b) ΔS < 0 da B a A
L'entropia è indipendente dalla trasformazione che collega gli stati à è una funzione di stato.
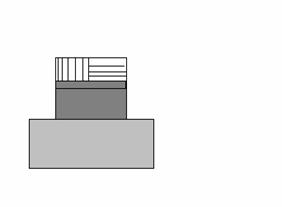
Tolgo 2 pesi in una sola volta à no stati intermedià ciclo irreversibile.
Ogni volta che si manifesta una trasformazione irreversibile che porta il sistema da uno stato A a uno B avrà ΔS > 0 à ∑Q/T > 0 à possiamo affermare che ogni volta che si manifesta in un sistema isolato una trasformazione irreversibile da A a B la variazione di entropia è sempre positiva.
Se la trasformazione è spontaneamente reversibile à potremmo ordinare temporalmente gli eventi che si manifestano nel sistema isolato e calcolare la ΔS:
ΔS (AB) > 0 se A precede B ; ΔS (AB) < 0 se B precede A
entropia nelle trasformazioni:
- adiabatica: ΔS =0 poiché Q=0
- isoterma: ΔS = 1/T*∑Qi àn*R*ln(Vb/Va) poiché T = costante
- isocora : ΔS = n*Cv*ln(cTi/Ti)
- isobara: ΔS = n*Cp*ln(ΔTi/Ti)
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta