| fisica |
|
|||||
|
La temperatura è una grandezza scalare che indica lo stato termico di un corpo. La temperatura si misura con il termometro.
Due corpi che hanno uno stato termico diverso fra loro, se messi a contatto raggiungono lo stesso stato termico, tale stato è detto di equilibrio termico.
Principio zero della termodinamica: se due corpi sono in equilibrio termico con un terzo, essi sono in equilibrio termico fra loro.
Il termometro a liquido è costituito da un bulbo di vetro contenente un liquido, in genere si utilizza il mercurio poiché rimane liquido anche a basse temperature. Il bulbo è direttamente connesso con un tubo capillare che viene chiuso all'altro estremo dopo aver estratto l'aria.
Il volume del liquido V varia al variare della temperatura a cui si trova lo strumento. Per esprimere la relazione di proporzionalità tra temperatura e volume è necessario tarare il termometro in modo da poter costruire una scala della temperatura. Ciò si può ottenere cercando di stabilire due temperature fisse di riferimento, cioè due punti fissi i cui valori restino rigorosamente costanti. Per consuetudine si assumono come temperature di riferimento quelle del ghiaccio fondente e dei vapori di acqua bollente entrambe valutate alla pressione di 1 atm.
Nella scala Celsius detta anche scala centigrada si assegna il valore 0 alla temperatura del ghiaccio fondente e 100 al secondo punto fisso, si indicano rispettivamente 0°C e 100°C.
Oltre alla scala Celsius sono usate anche le scale Réamur e Fahrenheit. Nella scala di Rèamur si assegna 0 alla temperatura del ghiaccio fondente e 80 a quella dei vapori di acqua bollente, sempre alla pressione di 1 atm. Nella scala Fahrenheit alle predette temperature si fanno corrispondete 32°F e 212°F.
Quando due oggetti a diversa temperatura vengono messi a contatto, quello più caldo diminuisce la sua temperatura e quello più freddo ha aumentato la sua temperatura. Si dice allora che il corpo a temperatura maggiore ha ceduto una quantità di calore al corpo più freddo.
Bisogna sottolineare che non ha senso parlare di quantità di calore posseduta da un corpo.
Il calorimetro è uno strumento mediante il quale è possibile confrontare e quindi misurare le quantità di calore scambiate fra i corpi.
Il calore è una forma di energia e può essere misurato nelle stesse unità di misura (joule, erg, .) utilizzate per l'energia meccanica.
Un'altra unità di misura per il calore è la caloria.
Si assume come unità di misura la caloria (cal) definita dalla quantità di calore che si deve fornire alla massa di 1 g di acqua per elevare la sua temperatura da 14,5°C a 15,5°C.
In pratica si usa un multiplo della caloria, la kilocaloria (kcal).
Dall'esperienza, se due corpi sono a differente temperatura:
la quantità di calore ceduta da un corpo aumenta all'aumentare della sua temperatura
due corpi della stessa sostanza mantenuti alla stessa temperatura cedono due diverse quantità di calore se hanno massa diversa: in particolare ne cede di più quello di massa maggiore
a parità di condizioni, la quantità di calore ceduta da un corpo dipende dalla natura del corpo
tutto ciò si può tradurre nella legge:
![]()
dove Q è la quantità di calore ceduta dal
corpo di massa m, quando la
temperatura diminuisce di ![]() gradi e c è una costante di proporzionalità
caratteristica della natura del corpo considerato. Tale costante di
proporzionalità si chiama calore
specifico del corpo e viene espressa in
gradi e c è una costante di proporzionalità
caratteristica della natura del corpo considerato. Tale costante di
proporzionalità si chiama calore
specifico del corpo e viene espressa in ![]() .
.
La quantità ![]() si chiama capacità
termica del corpo.
si chiama capacità
termica del corpo.
In realtà non ha senso parlare di calore specifico di un corpo se non sono precisate le condizioni sotto cui lo riscaldiamo e lo raffreddiamo: se a volume costante o a pressione costante.
Poiché in generale le variazioni di temperatura avvengono alla pressione atmosferica, ci riferiamo sempre al calore specifico a pressione costante.
La proazione del calore o meglio dell'energia termica fra due corpi a diverse temperature può avvenire secondo tre processi.
Questo processo si verifica quando, attraverso una successione continua di mezzi materiali, il calore passa da un corpo a temperatura maggiore ad un altro a temperatura minore, senza che vi sia spostamento di materia o alterazione macroscopica dei mezzi.
La trasmissione del calore per conduzione è caratteristica dei corpi solidi.
La quantità di
calore Q che si proa nel tempo ![]() attraverso una parete
di spessore d, piccolo rispetto alle
dimensioni delle facce parallele, mantenute a temperatura costante
attraverso una parete
di spessore d, piccolo rispetto alle
dimensioni delle facce parallele, mantenute a temperatura costante ![]() e
e ![]() è data dalla relazione
di Fourier:
è data dalla relazione
di Fourier:
![]() ,
,
dove S è un elemento di superficie della parete, K è detto coefficiente di conducibilità termica. Il segno negativo deriva dal fatto che il calore fluisce in senso contrario a quello secondo cui cresce la temperatura.
Questo processo si verifica quando la proazione del calore è accomnata da trasporto di materia. Tale fenomeno è possibile solo nei fluidi e si origina a causa delle correnti convettive, prodotte dalle differenze di densità che si manifestano nel fluido per effetto delle variazioni locali di temperatura.
Il trasferimento di calore per conone può essere espresso da:
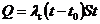
dove ![]() rappresenta il
coefficiente di conduttività termica esterna.
rappresenta il
coefficiente di conduttività termica esterna.
Il trasferimento di calore per irraggiamento avviene sotto forma di onde elettromagnetiche le cui componenti sono chiamate radiazioni termiche o infrarosse. Nell'irraggiamento il calore si proa non solo nella materia ma anche nel vuoto.
Quando si riscalda un corpo, l'energia emessa, legata alla natura del corpo, cresce rapidamente all'aumentare della temperatura.
FUSIONE
Si chiama fusione il passaggio dallo stato solido allo stato liquido, la trasformazione inversa si chiama solidificazione.
Dai risultati sperimentali risulta che:
a una determinata pressione ogni sostanza cristallina, presenta una caratteristica temperatura di fusione, che coincide con la temperatura di solidificazione
sia durante la fusione che nelle solidificazione, la temperatura rimane costante
la temperatura di fusione (solidificazione) varia con la pressione: in particolare, per le sostanze che fondendo aumentano di volume (e sono in maggioranza), un aumento di pressione determina un innalzamento della temperatura di fusione, per le sostanze che fondendo diminuiscono di volume (sono poche - ghiaccio, ghisa, argento,.) un aumento di pressione determina un abbassamento del punto di fusione.
Si chiama calore (latente) di fusione la quantità di calore che occorre fornire a pressione costante alla massa unitaria di un solido, portato alla temperatura di fusione, per ottenere, senza alterare la temperatura, il suo passaggio completo allo stato liquido.
In maniera analoga si definisce il calore di solidificazione.
La soprafusione è un particolare fenomeno che si verifica quando il raffreddamento del liquido avviene lentamente senza scosse e in un recipiente pulito. La soprafusione rappresenta una condizione metastabile, nel senso che basta agitare un poco il liquido o introdurre un pezzetto della stessa sostanza, perché tutta la massa fluida solidifichi immediatamente.
EVAPORAZIONE
L'evaporazione particolare tipo di vaporizzazione, riguarda il passaggio spontaneo a qualsiasi temperatura dalla fase liquida a quella aeriforme.
Per trattare in modo operativo questo cambiamento di fase si introduce il calore di evaporazione definito come la quantità di calore necessaria per far evaporare isotermicamente a una data temperatura 1 kg di liquido mantenuto a pressione normale.
Se il liquido è contenuto in un ambiente limitato, il numero di molecole che evaporano non può aumentare indefinitamente. Raggiunto un certo livello dipendente dal liquido, non c'è più evaporazione. Ciò vuol dire che il volume sovrastante il liquido è saturo e non può più contenere altre molecole in fase gassosa.
L'evaporazione di un liquido aumenta all'aumentare della temperatura. Il liquido passato allo stato aeriforme esercita una pressione sul liquido non ancora evaporato. La massima pressione esercitata dal vapore si chiama tensione del vapore saturo.
EBOLLIZIONE
L'ebollizione è la cosiddetta evaporazione tumultuosa e si manifesta in tutta la massa di un liquido a una determinata temperatura.
Un liquido bolle per quel particolare valore della temperatura per cui la tensione del proprio vapore saturo eguaglia la pressione che sovrasta il liquido. Variando la pressione esterna si può far variare la temperatura di ebollizione.
Poiché la tensione di vapore saturo dell'acqua alla temperatura di 100°C è 1 atm, discende che sotto questa pressione esterna l'acqua bolle a 100°C. Essendo la tensione di vapore saturo una funzione crescente della temperatura, si ha che la temperatura di ebollizione dell'acqua è inferiore o superiore a 100°C se la pressione esterna è inferiore o superiore a 1 atm, rispettivamente.
Dall'esperienza discende che:
sotto una data pressione ogni liquido bolle ad una temperatura sua propria, detta punto di ebollizione
durante l'ebollizione, cioè finché tutto il liquido non si è trasformato in vapore, la temperatura rimane costante
il punto di ebollizione cresce con la pressione sovrastante il liquido
La quantità di calore necessaria per far vaporizzare mediante ebollizione 1 kg di un liquido, preventivamente portato al punto di ebollizione sotto pressione normale, si chiama calore di ebollizione.
Le grandezze che possono rappresentare una data quantità di gas sono il volume, la pressione, la temperatura.
A temperatura costante, il volume di una massa di gas è inversamente proporzionale alla sua pressione (legge di Boyle)
In forma analitica:
![]()
pallone sott'acqua
In tutti i gas, mantenendo costante la pressione, a ogni determinato aumento di temperatura corrisponde lo stesso aumento di volume (legge di Gay-Lussac)
In forma analitica:
![]()
dove ![]() è il volume iniziale
del gas alla temperatura di
è il volume iniziale
del gas alla temperatura di ![]() il volume alla
temperatura di t°C e
il volume alla
temperatura di t°C e ![]() è una costante uguale
per tutti i gas il cui valore è pari a
è una costante uguale
per tutti i gas il cui valore è pari a ![]() .
.
Pallone sul termosifone
In tutti i gas, mantenendo costante il volume, a ogni aumento di temperatura corrisponde lo stesso aumento di pressione
In forma analitica:
![]()
dove ![]() è la pressione del gas
alla temperatura di
è la pressione del gas
alla temperatura di ![]() la sua pressione alla
temperatura di t°C e
la sua pressione alla
temperatura di t°C e ![]() è la precedente
costante.
è la precedente
costante.
Birra alla spina
Si definisce gas perfetto un gas che soddisfa esattamente alle leggi precedenti.
L'equazione di stato dei gas perfetti:
![]()
La termodinamica so occupa degli scambi energetici fra un sistema e l'ambiente con cui esso può interagire, con particolare riguardo alla trasformazione di lavoro in calore e di calore in lavoro.
Calore e lavoro sono due forme diverse della stessa grandezza fisica: l'energia.
Il calore rappresenta una forma di energia in transito attraverso un contorno a causa di una differenza di temperatura fra l'interno del contorno e il mezzo circostante.
Primo Principio della Termodinamica
Nella definizione più generale, il primo principio della termodinamica contiene tre aspetti fondamentali:
postula l'esistenza di una funzione chiamata energia interna
conferma la definizione operativa di calore come forma di energia in transito a causa di una differenza di temperatura
rappresenta la formulazione più generalizzata del principio di conservazione dell'energia
Il primo principio della termodinamica può essere enunciato come segue:
Qualunque sia il processo, la composizione chimica del sistema e il modo di scambiare calore e lavoro fra un sistema e l'ambiente esterno, la somma algebrica di Q (calore) ed L (lavoro) dipende unicamente dagli stati iniziale e finale del sistema, e non dalla particolare trasformazione, ed uguaglia la relativa variazione positiva o negativa dell'energia interna.
Il primo principio, dato che caratterizza ogni processo energetico, postula l'impossibilità tecnica e concettuale del cosiddetto moto perpetuo di prima specie. Con questa dizione si intende un dispositivo capace di produrre lavoro continuativo senza spesa di una equivalente quantità di energia.
Il fallimento di tutti i tentativi eseguiti per costruire una tale macchina può rappresentare una conferma a posteriori del primo principio della termodinamica.
Il secondo principio, chiamato anche principio dell'aumento dell'entropia, ha incontrato una certa diffidenza prima di essere accettato definitivamente nel ristretto gruppo di principi fondamentali.
Si vuole inoltre sottolineare l'assoluta indipendenza tra il primo ed il secondo principio.
A differenza del primo, il secondo principio si presenta come un fatto completamente nuovo e quasi estraneo al senso comune, tanto è vero che molti filosofi e anche molti fisici cercarono, soprattutto all'inizio, di contestarne in tutti i modi la validità.
La stessa grandezza entropia, introdotta da Clausius per dare una formulazione teorica rigorosa al principio, era inizialmente, e forse ancora oggi almeno per molti, qualche cosa di astratto e misterioso. A parte il fatto che essa sembrava non avere alcuna utilità pratica, la sua definizione operativa non è immediata: non esiste infatti un misuratore di entropia, cioè un dispositivo sperimentale che possa fornircene direttamente il valore.
Come è stato messo in evidenza, il concetto fondamentale del primo principio della termodinamica è rappresentato dalla conservazione dell'energia: le varie forme di energia si possono trasformare le une nelle altre in modo che l'energia totale rimanga sempre costante.
Il primo principio però non stabilisce alcuna condizione nei riguardi della convertibilità, tutte le energie sono infatti equivalenti ai fini delle possibili trasformazioni dirette e inverse e da una forma a un'altra. Ora, mentre alcune forme, come l'energia meccanica o elettromagnetica, si possono trasformare senza alcuna limitazione in energia termica, le trasformazioni inverse sono soggette a condizioni fisiche precise e definite. In altre parole, la natura fissa un senso privilegiato alle trasformazioni energetiche.
Se fosse possibile convertire senza condizioni calore in lavoro potremmo utilizzare un dispositivo che preleva calore dall'ambiente esterno e lo trasforma in lavoro. Essendo la capacità termica della Terra praticamente illimitata, si realizzerebbe così un moto perpetuo di seconda specie, cioè una macchina che, senza violare alcuna legge di conservazione, trasformerebbe, indefinitamente nel tempo e senza spesa di produzione, calore in energia meccanica o elettromagnetica utilizzando una sola sorgente a una generica temperatura.
Il secondo principio nega la possibilità tecnica e concettuale del moto perpetuo di seconda specie.
Come si osserva, le varie forme di energia possono trasformarsi le une nelle altre, il calore però si comporta in modo alquanto diverso dall'energia potenziale, cinetica, elettromagnetica, .., spesso chiamate energie di prima specie. Ai fini delle trasformazioni energetiche, il calore è una forma di energia di serie B, difficilmente convertibile in altre forme di energia più pregiate, o meglio non convertibile senza speciali permessi e condizioni. Questa limitazione si giustifica perché, in tutti i fenomeni di trasformazioni energetiche, il calore si estrinseca come una forma per così dire degradata, tanto meno utilizzabile quanto minore è la temperatura media alla quale è disponibile.
Il calore quindi rappresenta una forma di energia di seconda specie.
Nessuno è mai riuscito a produrre con continuità energia meccanica dal solo raffreddamento di un sistema, cioè nessuno è mai riuscito a costruire una macchina reale che possa trasformare in lavoro il calore sottratto da una sola sorgente, senza cederne una quantità finita a un'altra a temperatura minore.
Il secondo principio può essere così enunciato:
E' impossibile realizzare una trasformazione il cui risultato finale sia solamente quello di convertire in energia meccanica o elettromagnetica il calore prelevato da una sola sorgente.
Dal secondo principio otteniamo un postulato dovuto a Clausius:
E' impossibile realizzare una trasformazione, il cui risultato finale sia solamente il passaggio di calore da un corpo a una data temperatura a un altro avente temperatura maggiore del primo.
Il teorema di Nernst detto anche terzo principio della termodinamica afferma che non è possibile, con un processo composto da un numero finito di passi, raffreddare un corpo fino allo zero assoluto.
Si tratta di un risultato teorico.
Una trasformazione adiabatica è una trasformazione che avviene senza scambio di calore tra il sistema e l'ambiente esterno.
Una trasformazione isobara è una trasformazione che avviene a pressione costante.
Una trasformazione isotermica è una trasformazione che avviene a temperatura costante.
Si definisce rendimento di una qualsiasi macchina
capace di trasformare calore in lavoro, il rapporto tra il lavoro utile ![]() e l'energia termica
e l'energia termica ![]() assorbita dalla
sorgente a temperatura maggiore.
assorbita dalla
sorgente a temperatura maggiore.
In simboli:
![]() .
.
Tale formula vale
per qualsiasi macchina termica che esegue un ciclo di trasformazioni. L rappresenta il lavoro complessivamente
compiuto dal sistema durante il ciclo e ![]() solo il calore
assorbito durante il ciclo.
solo il calore
assorbito durante il ciclo.
Una macchina reversibile è un dispositivo
che compie una trasformazione ciclica reversibile. Se tale trasformazione è
composta di più fasi, ognuna di esse deve essere una trasformazione
reversibile. Grazie a questo concetto, è possibile dimostrare un teorema molto
importante, il teorema di Carnot,
che si riferisce a una macchina termica qualunque che funzioni con due sole
sorgenti di calore a diverse temperature. Più precisamente, il teorema di
Carnot stabilisce che, data una macchina reversibile R, il cui rendimento è ![]() , e un'altra macchina qualunque S, con rendimento
, e un'altra macchina qualunque S, con rendimento ![]() , che lavora tra le stesse due temperature di R, si ha sempre
, che lavora tra le stesse due temperature di R, si ha sempre
![]() .
.
Inoltre, il segno di uguale vale se e solo se anche la macchina S è reversibile.
Il ciclo di Carnot è costituito da quattro fasi consecutive: un'espansione isotermica, un'espansione adiabatica, una compressione isoterma e, infine, una compressione adiabatica che riporti il sistema allo stato iniziale.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta