| fisica |
|
Misure di densità
L'obiettivo di questi esperimenti è stato quello di misurare la densità.
La densità si definisce come
Abbiamo misurato la densità di un solido di forma "regolare", di alcuni liquidi, di un solido di forma irregolare e di un gas (anidride carbonica).
La misura della densità è una misura indiretta poiché per calcolarla dobbiamo conoscere volume e massa del corpo di cui vogliamo conoscere la densità.
I tre esperimenti che abbiamo eseguito sono stati:
L'obiettivo di questo esperimento era quello di misurare la densità di alcuni liquidi. Per eseguire questo esperimento abbiamo avuto bisogno di un cilindro graduato (sensibilità =1 cm3 ), di una bilancia (sensibilità = 0,01 g), di un po' d'acqua, alcool e glicerina.


Bilancia Cilindro Graduato
Prima di tutto abbiamo massato il cilindro graduato. Successivamente abbiamo versato nel cilindro un certo volume di acqua e abbiamo massato il cilindro insieme all'acqua. Con una semplice sottrazione siamo venuti a conoscenza della massa dell'acqua. A quel punto abbiamo calcolato la densità. Abbiamo ripetuto questa operazione più volte e poi, sempre con lo stesso procedimento abbiamo calcolato la densità dell'alcool e della glicerina.
I dati che abbiamo raccolto sono i seguenti:
d = m / V
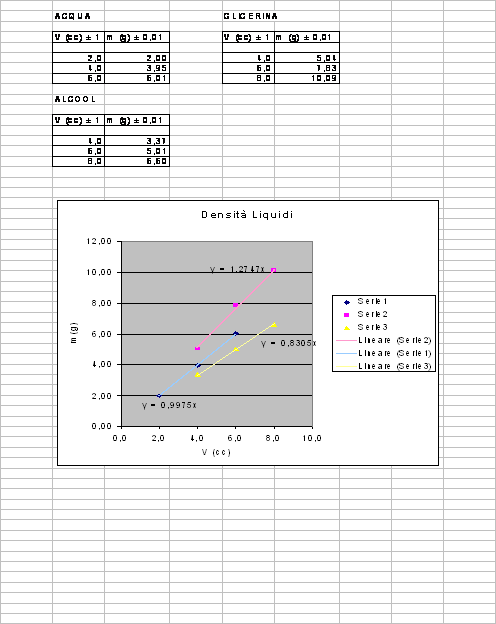
ACQUA
d1= 2,00 / 2,0=
=1,0 g / cc
d2 = 3,95 / 4,0 =
= 1,0 g / cc
d3 = 6,01 / 6,0 =
=1,0 g / cc
1,0 g / cc
d1 = 3,37 / 4,0=
= 0,84 g / cc
d2 = 5,01 / 6,0 =
= 0,84 g / cc
d3 = 6,60 / 8,0 =
= 0,83 g / cc
D = (0,84 + 0,84 + 0,83) / 3=
0,84 g / cc
GLICERINA
d1 = 5,04 / 4,0 =
= 1,26 g / cc
d3 = 7,83 / 6,0 =
= 1,31 g /cc
d4 = 10,09 / 8,0 =
= 1,26 g / cc
D = (1,26 + 1,31 + 1,26) / 3 =
= 1,28 g / cc
Osservando il grafico si nota che la retta del liquido con la pendenza maggiore (glicerina) è quello con densità maggiore. Non è una coincidenza, infatti il coefficiente angolare (il numero che quantifica la pendenza di una retta nel piano) è la densità del liquido stesso.
Le più probabili cause d'errore sono:
La possibilità che uno spostamento d'aria abbia influito sulla misurazione della massa;
Dopo avere svuotato il cilindro graduato qualche goccia di liquido può essere rimasta dentro il cilindro e si è mischiata al liquido successivo.
LEGENDA: d1 = densità nel primo caso d2 = "
" secondo caso d3 ="
" terzo caso m = massa V = volume D = densità
Lo scopo di questo esperimento era quello di misurare la densità di un solido irregolare (un sasso). Ci sono serviti: un sasso, una bilancia (sensibilità = 0,01 g) e un cilindro graduato (sensibilità 0,05 cc).
Per eseguire questo esperimento ci abbiamo
messo 55 minuti

![]()
![]()
Bilancia Cilindro Graduato

2,0 cc
Vs = va + vs =
= 0,5 + 0,5 =
= 1 cc
Vs = (2,0 ± 1) cc
Ms = (5,40 ± 0,01) g
d = m / V =
LEGENDA Va = volume dell'acqua Vas = volume dell'acqua con il
solido Vs = volume del solido ms = massa del solido
= 2,7 g / cc
d = (V / V + ms / ms) * d =
= (1 / 2,0 + 0,01 / 5,40) * 2,7=
= (0,5 + 2 * 10-3) * 2,7=
= 0,5 * 2,7=
= 1,35 cc
d = (2,7 ± 1,35) g / cc
Lo scopo di questo esperimento è stato quello di misurare la densità di u gas (anidride carbonica).
Per eseguire questo esperimento ci sono serviti : un secchio, una bottiglia, una beuta, un cilindro graduato (sensibilità = 10 cc), una compressa effervescente (Alka-seltzer) e una bilancia elettronica (sensibilità = 0,01 g).



![]()
![]()
![]()

Beuta Bilancia Bottiglia Cilindro graduato
Tappo con tubo flessibile Secchio Compressa efferv
![]()
![]()



![]()
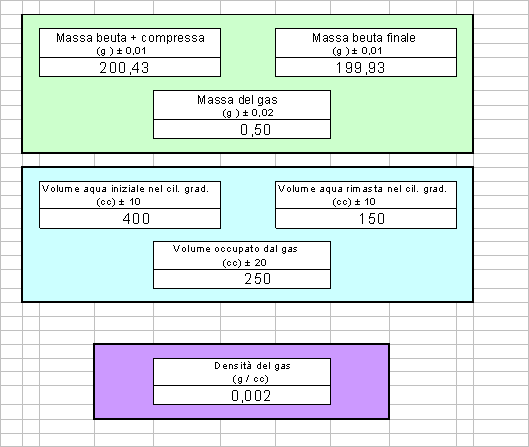
Prima di tutto abbiamo riempito la beuta di acqua fino a metà. Facendo molta attenzione abbiamo scartato la compressa effervescente dopodiché abbiamo messo sul piatto della bilancia la beuta e la compressa per massarle. Abbiamo poi riempito la bottiglia di acqua fino all'orlo facendo molta attenzione a non lasciare aria dentro la bottiglia. Tenendo tappata la bottiglia con il palmo della mano, l'abbiamo messa a "a testa in giù" nel secchi, precedentemente riempito fino a metà di acqua. Con molta cautela, abbiamo inserito il tubo flessibile nella bottiglia, mandandolo fino in cima. Successivamente abbiamo inserito la compressa effervescente nella beuta e immediatamente abbiamo tappato quest'ultima con il tappo collegato al tubo. Per circa 5 - 7 minuti abbiamo aspettato che la compressa si sciogliesse completamente, dandole ogni tanto una mano agitando la beuta. A scioglimento avvenuto, abbiamo estratto il tubo (facendo naturalmente attenzione a non sollevare la bottiglia) dopodiché abbiamo tirato fuori la bottiglia dal secchio tenendo tappata l'imboccatura. Riempito il cilindro fino a una quantità nota di acqua. Abbiamo poi versato un po' d'acqua del cilindro nella bottiglia, fino a riempirla fino all'orlo e facendo attenzione a non farla traboccare. Infine abbiamo massato la beuta con la compressa disciolta. Facendo la differenza tra il valore della massa della beuta con la compressa intera e la massa della beuta con la compressa disciolta abbiamo ricavato il valore della massa del gas disciolto. Facendo ancora un'altra differenza, tra il valore dl volume dell'acqua iniziale nel cilindro graduato e quello finale, siamo venuti a conoscenza del volume occupato dal gas. Facendo la divisione tra la massa e il volume abbiamo calcolato la densità.
I dati sperimentali raccolti sono :
Le cause
d'errore in questo esperimento sono molte. Le più importanti sono:
Data l'elevata precisione della bilancia, un benché minimo spostamento d'aria potrebbe avere falsato la misura della massa;
Il menisco dell'acqua potrebbe avere ingannato l'operatore nel leggere il livello dell'acqua nel cilindro graduato;
Dopo avere messo la compressa effervescente nella beuta, l'operatore potrebbe non avere chiuso subito l'imboccatura della beuta con il tappo e ci sarebbe stata una perdita di gas;
L'operatore potrebbe avere toccato la compressa con le mani non perfettamente asciutte, e la compressa avrebbe iniziato a sciogliersi e ci sarebbe stata anche qui un perdita di gas;
Dentro la bottiglia ci potrebbe essere stata una bolla d'aria che avrebbe influenzato la misura del volume occupato dal gas;
Nel versare l'acqua del cilindro graduato nella bottiglia, un po' d'acqua avrebbe potuto traboccare.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta