| fisica |
|
|||||
|
Termodinamica
I sistemi fisici di cui si occupa la termodinamica sono costituiti da un
numero grandissimo di sistemi elementari come atomi o molecole; il più
semplice esempio di un sistema di tal fatta è un fluido omogeneo
contenuto in un recipiente. Lo stato in cui questo tipo di sistema si trova si
considera sufficientemente caratterizzato quando si conoscono il valore della
temperatura, della pressione,
![]()
dove U(B) e U(A) sono i valori dell'energia
interna calcolati nei due stati B e A; possiamo dunque dire che la variazione
di energia interna durante una trasformazione fra due stati qualsiasi non
dipende dal tipo di trasformazione effettuata, ma solo dagli stati estremi A e
B. Il primo principio asserisce che il lavoro può trasformarsi in calore
e viceversa, ma non fornisce informazioni sulle modalità di questa
trasformazione. I limiti della trasformabilità tra calore e lavoro sono
chiariti dal secondo principio della termodinamica il quale stabilisce che il
calore è una forma di energia degradata ed è tanto più
degradata quanto più la temperatura della sorgente di calore è
bassa; il carattere degradato di questa forma di energia consiste nel fatto che
il calore, a differenza delle altre forme di energia, non può
trasformarsi integralmente in lavoro. Precisamente si osserva che è
impossibile realizzare una trasformazione il cui unico risultato sia la
trasformazione in lavoro di calore tratto da un'unica sorgente a temperatura
uniforme; questo è l'enunciato
Poiché non è possibile trasformare in lavoro il calore preso da un'unica sorgente occorrono almeno due sorgenti se si vuole realizzare una tale trasformazione. Il più semplice ciclo termodinamico reversibile che opera tra due sorgenti di temperatura t1 e t2 (t2 > t1) è il ciclo di Carnot costituito da un'espansione isoterma AB alla temperatura t2, durante la quale il sistema assorbe una quantità di calore Q2, un'espansione adiabatica BC durante la quale la temperatura del sistema passa da t2 a t1 (temperatura della seconda sorgente), una compressione isoterma CD alla temperatura t, durante la quale il sistema cede una quantità di calore Q2, e infine una compressione adiabatica DA che porta il sistema nello stato di partenza A. Dopo un ciclo il sistema fornisce all'esterno, in base al primo principio della termodinamica, una quantità di lavoro L data dalla relazione L = Q2 - Q1. Applicando al ciclo di Carnot o a ogni altro ciclo compiuto fra le temperature t1 e t2 il secondo principio della termodinamica si dimostra che tutti i cicli reversibili hanno lo stesso rendimento hr, che dipende unicamente dalle temperature delle sorgenti, mentre i cicli irreversibili (cioè quelli che avvengono effettivamente in natura) hanno rendimenti hi che non superano mai quello dei cicli reversibili. Tradotte in formule queste asserzioni assumono la forma:
![]()
dove T1 e T2 sono le temperature termodinamiche assolute delle sorgenti. Dal secondo principio si deduce facilmente che per ogni ciclo reversibile vale la relazione ; ñdQ/T = 0 mentre per i cicli irreversibili si ha ; ñdQ/T
Dalla prima relazione si deduce, analogamente a
quanto si fa per il primo principio, che la quantità dS = dQ/T
calcolata per una trasformazione infinitesima reversibile è un
differenziale esatto; ne segue che l'integrale ![]() esteso a una trasformazione
reversibile da A a B vale S(B)-S(A), cioè dipende solo dagli stati
estremi e non dal tipo di trasformazione reversibile effettuata. La funzione
S(A) che così viene definita (a meno di una costante additiva) è
l'entropia
esteso a una trasformazione
reversibile da A a B vale S(B)-S(A), cioè dipende solo dagli stati
estremi e non dal tipo di trasformazione reversibile effettuata. La funzione
S(A) che così viene definita (a meno di una costante additiva) è
l'entropia ![]() , dove l'integrale da A a B è calcolato lungo la
trasformazione irreversibile. Se il sistema è isolato, cioè DQ = 0, dalla formula precedente si deduce che S(B) S(A), cioè: per una qualunque trasformazione che avviene in
un sistema isolato, l'entropia dello stato finale non è mai inferiore a
quella dello stato iniziale; in altre parole l'entropia di un sistema isolato
non può che crescere ed è costante solo quando il sistema
raggiunge uno stato di equilibrio. Questa asserzione costituisce un'ulteriore
formulazione
, dove l'integrale da A a B è calcolato lungo la
trasformazione irreversibile. Se il sistema è isolato, cioè DQ = 0, dalla formula precedente si deduce che S(B) S(A), cioè: per una qualunque trasformazione che avviene in
un sistema isolato, l'entropia dello stato finale non è mai inferiore a
quella dello stato iniziale; in altre parole l'entropia di un sistema isolato
non può che crescere ed è costante solo quando il sistema
raggiunge uno stato di equilibrio. Questa asserzione costituisce un'ulteriore
formulazione
Reversibile
Si dice di ogni trasformazione meccanica, fisica, chimica, che possa, in un istante qualsiasi, invertire il senso del proprio processo, a causa di una forza esterna che modifichi di poco le condizioni che permettono il verificarsi del fenomeno. (Tutti gli stati attraverso cui passa un sistema che subisce una trasformazione termodinamica reversibile sono stati di equilibrio.) Si dice di un fenomeno per il quale la causa e l'effetto possono essere invertiti. (Per es. il funzionamento di una dinamo è reversibile, nel senso che essa può comportarsi come un motore elettrico.) Macchina reversibile, macchina o in generale sistema che compie o subisce una trasformazione termodinamica reversibile. (In natura non esistono macchine reversibili.)
Ciclo
In un sistema termodinamico definito dalla pressione p, dal volume specifico o dal volume molare v e dalla temperatura T, fra le tre grandezze intercorre una relazione del tipo f (p, v, T) =0, chiamata "equazione di stato". Nella rappresentazione sectiunesiana nello spazio, con p, v e T come coordinate, essa corrisponde a una superficie sulla quale ogni punto A individua uno stato possibile del sistema. Ogni mutamento di stato si ottiene variando almeno uno dei precedenti parametri, in modo che A descriva una curva sulla superficie. In particolare se, dopo una serie di trasformazioni, il sistema ritorna nelle condizioni iniziali il punto A descrive una curva chiusa, che caratterizza geometricamente il ciclo percorso dal sistema. Se si considera la proiezione Ao del punto A sul piano Opv, la trasformazione viene allora rappresentata da una curva funzione della pressione e del volume. Questa rappresentazione geometrica (diagramma di Clapeyron) ha il vantaggio di consentire un calcolo immediato del lavoro p dv scambiato dal sistema con l'esterno nel corso della trasformazione;
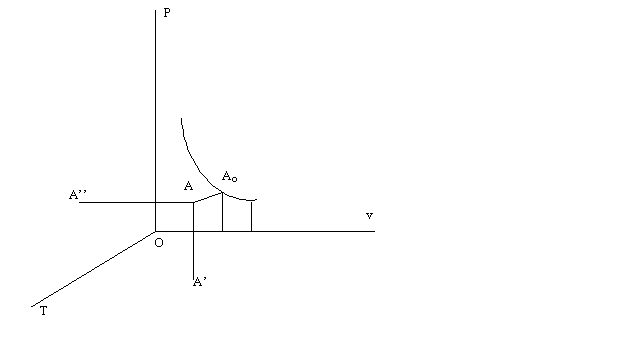
poiché trattasi di un ciclo, anche la curva sul piano p-v è chiusa e l'area da essa delimitata rappresenta il lavoro del sistema (lavoro compiuto dal sistema, se la curva è percorsa in senso orario, lavoro compiuto dall'esterno, se è percorsa in senso antiorario). Si dice che un ciclo è reversibile quando può essere compiuto indifferentemente nei due sensi: la condizione si verifica solo se temperatura e pressione del sistema sono, istante per istante, uguali a quelle esterne e non vi sono attriti. Un esempio di ciclo reversibile è fornito dal ciclo di Carnot
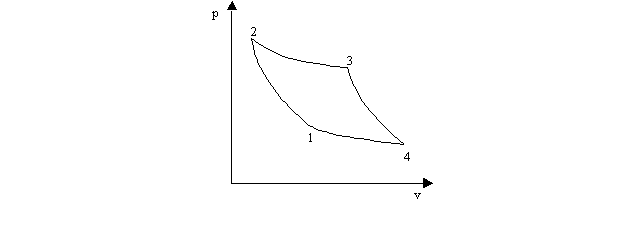
formato da due adiabatiche (1-2; 3-4) e da due isoterme (2-3; 4-l). Esso consente, fra l'altro, di definire la scala assoluta di temperature e di stabilire che ogni ciclo reversibile è caratterizzato dal fatto che
![]()
dove dQ è la quantità elementare di calore messa in gioco in ciascuna trasformazione infinitesima che compone il ciclo e T è la temperatura assoluta corrispondente.
Il ciclo di Carnot non si può realizzare in pratica; tuttavia esso ha grande importanza come ciclo teorico col quale poter confrontare gli altri cicli. Per le loro applicazioni pratiche sono importanti i cicli di Joule, Otto, Diesel e Rankine.
Il ciclo di Joule
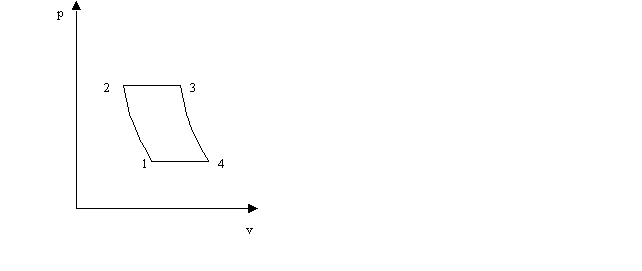
è costituito da una compressione adiabatica (1- 2), da un'isobara (2-3) lungo la quale viene assorbita una certa quantità di calore, da un'espansione adiabatica (3-4) e infine da un'altra isobara (4-l) in cui viene ceduto del calore. Se l'espansione viene fatta in turbina una parte del lavoro da essa svolto viene utilizzato per azionare il compressore. Il ciclo di Joule viene impiegato nelle turbine a combustione interna; inoltre è impiegato, in senso inverso, nelle macchine frigorigene.
Il ciclo Otto
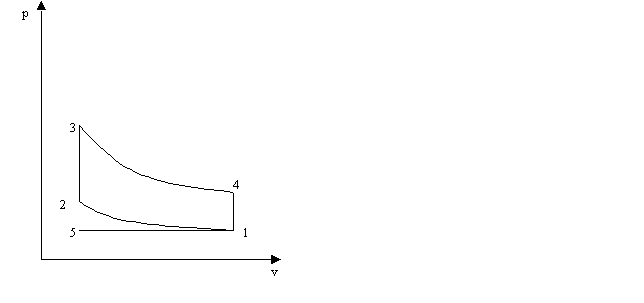
è il ciclo fondamentale dal quale derivano, con opportuni accorgimenti, i cicli impiegati nei motori a scoppio a quattro tempi (automobile, aeroplani a elica). È costituito da una compressione adiabatica (1- 2), da una combustione isocora o scoppio (2-3), da un'espansione adiabatica (3-4), da una riduzione di pressione isocora (4-l); a queste trasformazioni vanno aggiunti lo scarico (1-5) e l'ammissione di nuova miscela (5-l): il ciclo completo risulta di sei fasi e quattro tempi.
Il ciclo Diesel
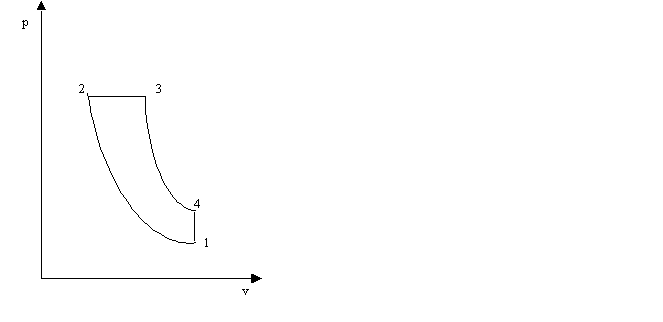
è usato nei motori diesel ed è costituito da una compressione adiabatica (1-2), da un'isobara (2-3) durante la quale viene fornito del calore (in pratica è una combustione), da un'espansione adiabatica (3-4) e da un'isocora (4- 1). Tutti i cicli citati finora impiegano fluidi allo stato gassoso; quando invece si opera nella zona in cui si ha cambiamento di stato da liquido a vapore, i cicli sono diversi, in relazione al fatto che durante il cambiamento di stato le isoterme coincidono con le isobare. Per gli impianti a vapore d'acqua, fondamentale è il ciclo di Rankine. Esso è costituito teoricamente da una compressione adiabatica dell'acqua (1-2), dal riscaldamento della stessa (2-2') fino alla curvalimite, dall'evaporazione (2'-3), da un'espansione adiabatica (3-4), dalla condensazione (4-l); il riscaldamento e l'evaporazione avvengono a pressione costante, quindi l'evaporazione è anche un'isoterma come pure isoterma è la condensazione.
L'applicazione di questo ciclo interessa le turbine e le motrici alternative a vapore e riguarda quindi un vasto campo di realizzazioni pratiche.
Entropia
Nome dato da Clausius alla funzione di stato termodinamica S = òdQ/T, ove dQ è la quantità di calore che il sistema in esame ha scambiato con l'esterno nel corso di una sua trasformazione reversibile infinitesimale, e T la temperatura assoluta alla quale è avvenuto lo scambio della quantità di calore dQ..
La variazione di entropia di un sistema può venir calcolata unicamente nel caso di trasformazioni reversibili, costituite da successioni continue di stati di equilibrio; essa dipende soltanto dagli stati iniziale e finale della trasformazione e non dal particolare tipo di trasformazione che ha portato da uno stato all'altro. Perciò la variazione di entropia è nulla se il sistema, alla fine di una trasformazione, ritorna nelle stesse condizioni iniziali; l'entropia di un sistema che percorre un ciclo chiuso reversibile rimane perciò costante. In accordo con il secondo principio della termodinamica l'entropia di un sistema isolato non diminuisce mai e aumenta nelle trasformazioni irreversibili, per es. nei processi spontanei in cui il sistema raggiunge uno stato di equilibrio.
L'entropia si può anche definire in forma statistica come una misura del grado di disordine di un sistema: esiste infatti una relazione precisa tra entropia e probabilità data dalla formula S = klog p dove k è la costante di Boltzmann e p la probabilità di uno stato del sistema, definita come il numero delle possibili conurazioni che danno origine allo stesso stato termodinamico. L'aumento di entropia che si manifesta in un sistema isolato che raggiunge uno stato di equilibrio può essere considerato come l'effetto della tendenza di ogni sistema a evolversi da uno stato meno probabile a uno stato più probabile. In un cristallo perfetto allo zero assoluto ogni suo costituente (atomo o molecola) occupa il livello più basso di energia: esiste quindi una sola conurazione possibile e perciò l'entropia del sistema è nulla (terzo principio della termodinamica).
Entalpia
Una delle funzioni di stato termodinamiche che caratterizzano il comportamento di un fluido.
Si definisce entalpia di un fluido la quantità H = pV + U, ove U è l'energia interna, p la pressione e V il volume. Per un gas perfetto, l'entalpia dipende soltanto dalla temperatura del gas, poiché ciascuna delle quantità precedenti è costante a temperatura costante. Per un sistema termodinamico arbitrario, l'entalpia dipende, in ogni caso, soltanto dallo stato del sistema stesso e le sue variazioni in una generica trasformazione dipendono soltanto dallo stato iniziale e da quello finale. L'entalpia interessa particolarmente i calcoli relativi al vapore d'acqua. In geotermica si definiscono fluidi ad alta entalpia i vapori e le acque calde che hanno una temperatura superiore a 130 ºC, fluidi a bassa entalpia le acque calde che hanno una temperatura fra 130 e 65 ºC.
Principio o teorema di Nernst
Legge della termodinamica enunciata per la prima volta da W. H. Nernst nel 1906 che asserisceche in un sistema costituito da una fase condensata (liquida o solida) valgono le relazioni
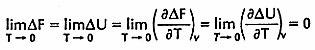
dove DF è la variazione di energia libera, DU la variazione di energia interna e T la temperatura assoluta (le derivate parziali sono calcolate a volume costante). In base a queste relazioni e in accordo con l'esperienza, si dimostra che la variazione DS di entropia tra tutti gli stati di un sistema condensato si annulla allo zero assoluto. Questo principio fu successivamente esteso da ck il quale suppose che allo zero assoluto F, S e U si annullino: l'estensione, benché sia accettabile nella grande maggioranza dei casi, possiede diverse eccezioni perciò attualmente si propende per una formulazione meno drastica che è nota come terzo principio della termodinamica: Allo zero assoluto la differenza di entropia DS tra tutti gli stati di un sistema che sono in equilibrio termico è nulla. Una delle più importanti conseguenze di questa legge è l'irraggiungibilità dello zero assoluto: in generale la temperatura di un sistema isolato può essere ridotta diminuendo adiabaticamente l'entropia del sistema; in accordo con l'enunciato precedente a mano a mano che la temperatura si abbassa la diminuzione di entropia che può subire il sistema diventa sempre più piccola ed è perciò impossibile raggiungere lo zero assoluto con un numero finito di trasformazioni. Un'altra conseguenza è l'annullarsi dei calori specifici e dei coefficienti di dilatazione quando la temperatura tende allo zero assoluto.
Adiabatica
Il termine adiabatico è stato introdotto nel linguaggio scientifico da Clausius, che lo applicò, inizialmente, in conformità al significato letterale di "impenetrabile" al calore. Venne successivamente ripreso da Rankine, ma soltanto Sadi Carnot e Clapeyron gli diedero l'attuale significato preciso e definitivo. Un corpo o un sistema di corpi è sottoposto a un processo adiabatico quando tutte le trasformazioni che subisce si realizzano senza scambi di calore col mezzo circostante: è il caso di un gas compresso in un cilindro assolutamente impermeabile al calore. Si consideri l'unità di massa di una data sostanza; essa occupa, in un certo istante, un volume V ed esercita una pressione p sulle pareti del recipiente che la racchiude. In una rappresentazione grafica in cui si riporta sulle ascisse il volume V e sulle ordinate la pressione p, si ottiene un punto M, detto punto rappresentativo dello stato del corpo. Sottoponendo la sostanza a una trasformazione adiabatica, il punto M descrive una curva detta linea adiabatica. La forma esatta della linea adiabatica, in generale, può essere determinata soltanto per via sperimentale: in tutti i casi però, la retta MT, tangente all'adiabatica in un generico punto, forma con l'asse delle pressioni un angolo più piccolo di quello della tangente MT´ all'isoterma (linea relativa a una trasformazione a temperatura costante) passante per lo stesso punto M.
Per un gas perfetto l'equazione delle trasformazioni adiabatiche è: pVv= costante, ove g rappresenta il rapporto fra i calori specifici del gas rispettivamente a pressione e a volume costante. La conoscenza delle linee adiabatiche, per un sistema costituito da un gas o da un vapore, fornisce notevoli informazioni sui fenomeni che si producono durante un'espansione o una compressione.
Il lavoro compiuto nel corso di una trasformazione adiabatica è rappresentato graficamente dall'area compresa fra l'asse delle ascisse, la curva adiabatica e le verticali che corrispondono allo stato iniziale e allo stato finale della trasformazione.
Le trasformazioni adiabatiche hanno grande importanza in termodinamica.
Isoterma
Linea isoterma, linea di un diagramma termodinamico che unisce i punti rappresentanti stati di un gas caratterizzati dalla medesima temperatura. (In coordinate p, V [pressione e volume] le isoterme sono rappresentate, per i gas perfetti, dall'equazione pV = k, dove k è una costante proporzionale al valore della temperatura assoluta: la curva che le rappresenta è perciò un'iperbole equilatera i cui asintoti coincidono con gli assi di riferimento.)
Isobara
Di uguale pressione. In termodinamica, si dice di una trasformazione nel corso della quale la pressione conserva un valore costante. (Una trasformazione isobara è rappresentata, per un gas perfetto, dall'equazione v = v0(1 + a t), che permette di determinare il volume v di una massa di gas alla temperatura di t °C quando si conosca il suo volume v0 alla temperatura di 0 ºC; a = 1/273,16 è il coefficiente di dilatazione termica, uguale per tutti i gas perfetti.)
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta