| tecnica |
|
Determinare per le reazioni riportate di seguito la costante di reazione k per tutte le specie coinvolte nella reazione. Assumere che il valore della kA sia di 25 con le appropriate unità di misura.
Per la reazione 2A + B C la cinetica è -rA=kA CA2CB.
Per la reazione ½ A + 3/2 B C la cinetica è -rA= kA CACB.
Per la reazione catalitizzata da un solido 4 A + 5 B 4 C + 6 D la cinetica è -r'A= kA CA2CB.
Per la reazione omogenea in fase gas CH4 + 3/2 O2 HCOOH + H2O che relazione c'è tra r CH4 e r O2?
Unità di misura: ![]()
![]()
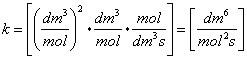
Sia: ![]()
Relazione che
esiste tra le velocità relative: ![]()
![]()
![]()
![]()
![]()
Unità di misura: ![]()
![]()
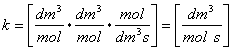
Sia: rA= -kA CACB
Relazione che
esiste tra le velocità relative: ![]()
![]()
![]()
![]()
![]()
La reazione è catalizzata da un solido
Unità di misura: 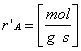
![]()
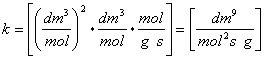
Sia: r'A= -kA CA2CB
Relazione che
esiste tra le velocità relative: ![]()
![]()
![]()
![]()
![]()
![]()
![]()
Per la reazione omogenea in fase gas CH4 + 3/2 O2 HCOOH + H2O si ha che:
![]()
La reazione in fase gas ½ N2 + 3/2 H2 NH3 viene condotta isotermicamente. La carica molare è del 50% H2 e 50% N2 alla pressione di 16.4 atm e 227°C.
½ N2 + 3/2 H2 NH3
Per una mole di N2
servono 3 moli di H2 . Quindi poiché ![]() si ha che l'H2
è il reagente limitante.
si ha che l'H2
è il reagente limitante.
Sia A=H2
B=N2
C=NH3
Quindi si che la
reazione può essere descritta: 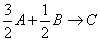 e moltiplicando tutto per 2/3
e moltiplicando tutto per 2/3
![]()

![]()
P = 16.4 atm
T = 227°C = 500 K
R = 0.0825 dm3 atm/mol K
![]()
![]()
![]()
Se la conversione dell' H2 è XA=60%, posso calcolare le concentrazioni dell' H2 e dell' N2
Per un reattore a
flusso si ha che la concentrazione per specie i-esima è: ![]()
La portata
volumetrica non è costante: ![]()
Poiché il
reattore è isotermo ![]() e le perdita di
carico trascurabili
e le perdita di
carico trascurabili ![]() si ha che:
si ha che: ![]()
Dunque: ![]()
![]()
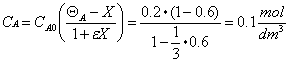
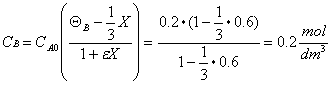
Poichè la reazione è elementare e kN2 = 40 dm3 / mol s allora si ha:
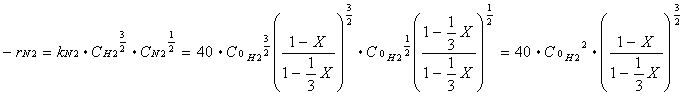
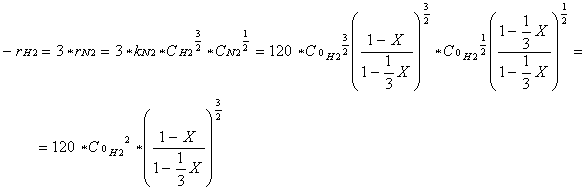

![]()
P = 16.4 atm
T = 227°C = 500 K
R = 0.0825 dm3 atm/mol K
![]()
![]()
![]()
Se la conversione dell' H2 è XA=60%, posso calcolare le concentrazioni dell' H2 e dell' N2
Per un reattore
batch si ha che la concentrazione per specie i-esima è: ![]()
Il volume è
costante: ![]()
Poichè il
reattore è isotermo ![]() e le perdita di
carico trascurabili
e le perdita di
carico trascurabili ![]() si ha che:
si ha che:
![]()
![]()
![]()
![]()
Poichè la reazione è elementare e kN2 = 40 dm3 / mol s allora si ha:
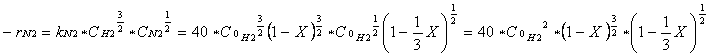
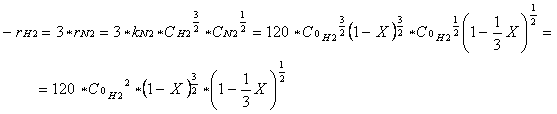
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta