| chimica |
|
|||||
|
Sono gli idrocarburi che hanno il metano come capostipite, il C con ibridizzazione tetraedrica ed il legame semplice C - C. In tabella è riportato l'avvio della serie degli idrocarburi saturi fino a 5 atomi di C, sviluppando la formula generaleCnH2n+2 ;oltre a quello di struttura si riporta anche la formula razionale che, condensano gli H sul C cui sono legati, costituisce un qualche cosa d'intermedio fra le due.
|
FORMULA BRUTA |
FORMULA RAZIONALE |
FORMULA DI STRUTURA |
NOME |
|
CH4 |
- |
H H - C - H H |
MET - ANO |
|
C2H6 |
CH3 - CH3 |
H H | | H - C - C - H | | H H |
ET - ANO |
|
C3H8 |
CH3 - CH2 - CH3 |
H H H | | | H - C - C - C - H | | | H H H |
PROP-ANO |
|
C4H10 |
CH3 - CH2- CH2 - CH3 |
H H H H | | | | H - C - C - C - C - H | | | | H H H H |
BUT - ANO |
|
C5H12 |
CH3 - (CH2 )3 - CH3 |
H H H H H | | | | | H - C - C - C - C - C - H | | | | | H H H H H |
PENT- ANO |
La radice del nome sistematico, valida non solo per gli alcani, è legata al numero di atomi di C.
NUMERO DI ATOMI DI C |
RADICE DEL NOME IN BASE AL NUMERO DI ATOMI DI C |
|
|
MET - |
|
|
ET - |
|
|
PROP - |
|
|
BUT - |
|
|
PENT - |
|
|
ES - |
|
|
EPT - |
|
|
OCT - |
|
|
NON - |
|
|
DEC - |
|
|
EICOS- |
Già si è detto che sulla base della rotazione intorno al legame C - C, non ha senso cercare se gli etani possano essere più di uno e la cosa vale anche per i termini superiori. Sotto un'ottica diversa, quella cioè della diversa concatenazione degli atomi di C, ha invece senso indagare su possibili differenze. Si prenda la formula bruta C4H10. Si vede subito che i quattroC possono essere concatenati in modo lineare[18] o in modo ramificato[19] e le due strutture rappresentano due molecole realmente diverse, fisicamente e chimicamente distinguibili. Quale delle due rappresenta il butano? Entrambe.
H H H H H H H 1 2 3
| | | | | | | CH3 - CH - CH3
H - C - C - C - C - H H - C - C - C - H |
| | | | | | | CH3
H H H H H H - C - H H
|
H
[18] [19] [19]
Se si prova con il pentano, si riesce a scriverne tre:
C - C - C - C - C C - C - C - C C
| |
C C - C - C
|
C
[20]
Con i C20H42 si riesce a scriverne 366.319! La coppia del butano [18]-[19], la terna del pentano [20]-[21]--[22] e così via, caratterizzate da ugual formula bruta, ma diversa formula di struttura costituiscono un esempio di ISOMERI DI STRUTTURA (detti anche isomeri di catena). Nasce immediatamente il problema della nomenclatura. La nomenclatura corrente indicava come n - butano [18] e come isobutano [19], ma come si fa a inventare 366.319 per l'eicosano? Ecco la necessità di una nomenclatura ufficiale. Per dare il nome ad un alcano la nomenclatura sistematica si basa su alcune regole che possono così essere considerate:
cercare la catena più lunga di atomi di C che fornirà la RADICE del nome;
numerare, preceduti da un numero il più piccolo possibile, i gruppi alchilici (alcani a cui manca un atomo di H), simboleggiati genericamente con -R ;
usare prefissi di molteplicità: MONO, BI, TRI, TETRA
ESEMPI:
CH3 - CH - CH3
| metilpropano [19]
CH3
Il butano [19] ha in realtà una catena di 3 atomi di C ( 3=radice prop - ) al secondo dei quali è attaccato l'alchile - CH3 (cioè metano senza un idrogeno, quindi metile). Dire che il -CH3 è attaccato al C2 è superfluo perché non vi sono alternative. La molecola si chiama ufficialmente METILPROPANO.
CH3 CH3
| |
5CH3 - 4CH - 3CH2 -2C - 1CH2 TRI-METIL - PENT-ANO
CH3 ( 2,2,4 TRIMETILPENTANO)
[23]
Radice PENT- ,prefisso di molteplicità TRI (perché ci sono tre metili); numerazione da destra a sinistra in modo da usare i numeri 2,2,4(questi numeri si riferiscono alla posizione dei gruppi metilici - CH3 ,più piccoli di 2,4,4 numerazione da sinistra).
Quest'esempio è utile per classificare gli atomi di C in :
PRIMARI → legati ad un solo C (sono tali tutti i gruppi - CH3 ) ;
SECONDARI → legati a due C ( - CH2 - del[23] )
TERZIARI → legati a tre C (il numero 4 del[23]) ;
QUATERNARI → legati a quattro C (il numero 2 del[23]) .
|
- C -
| | | | | | | | | |
C1 - C2 - C3 - C4 - C5 - C6 - C7 - C8 - C9 - C10
![]() | | | | | | | | |
| | | | | | | | |
- C - - C - | |
| | - C - - C - - C -
- C - | | |
|
Catena più lunga 10 C = radice del nome DEC - ; i gruppi alchilici vengono citati in ordine alfabetico, l'alchile in 7 ha 3 C, quindi è un propile, chiamato isopropile perché legato con il secondo dei tre C.
Il nome è: 5 ETIL - 7 ISOPROPIL - 3,3 DI METIL DECANO
Si noti che [19] è uno dei due butani, [23] uno dei tanti ottani e [24] uno dei tanti eptani.
Hanno nome di uso comune conservato :
[19] isobutano;
[21] isopentano,
[22] neopentano.
Si esaminino ora le principali proprietà fisiche degli alcani:
da C1 a C4 sono gassosi ed inodori( il metano viene odorizzato con additivi per individuarne le fughe);
da C5 a C8 sono liquidi ed hanno odore di benzina;
![]() da C9 a C sono liquidi inodori
da C9 a C sono liquidi inodori
- oltre C sono solidi
hanno densità massima 0,8 per cui galleggiano sull'acqua(inquinamento da scarico di petroliere;
mai spegnere un incendio di idrocarburi con acqua! );
non sono solubili in acqua.
Si è visto che, tra molecole non polari, si esercitano deboli forze attrattive a livello della superficie, chiamate forze di dispersione o di Van Der Waals. Sarà logico quindi che, al crescere delle dimensioni molecolari, si intensifichi la forza di attrazione reciproca e che lo stato fisico passi gradualmente da gassoso, a liquido, a solido. A pari massa molecolare, diventa determinante la forma della molecola :così ad esempio il pentano [20] bolle a temperatura più alta del neopentano [22], in quanto, pur avendo lo stesso peso molecolare, il pentano ha forma assimilabile ad un cilindro e tra cilindri le forze attrattive superficiali si esplicano meglio che non tra sfere (la cui zona di contatto è ridotta ad un punto).
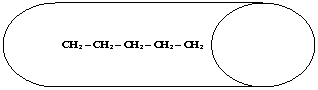
P. EB.=36ºC
[20]
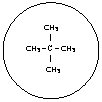
P. EB.=9,5°C
[22]
Sciogliere in acqua un idrocarburo significherebbe spendere energia per vincere l'attrazione idrocarburo - idrocarburo( debole), quella acqua - acqua (forte), per ricavarne quella di formazione dei legami deboli idrocarburo - acqua .
Una molecola fatta di atomi "leggeri"come C e H sarà logicamente leggera, cioè dotata di bassa densità. Si considerino ora gli aspetti chimici (preparativi e reazionali).
I primi sono presto esaminati in quanto di metano e dei suoi fratelli maggiori la natura ne offre in abbondanza nei giacimenti petroliferi. Può avere interesse la sintesi di alcani di struttura particolare.
Gli aspetti reazionali possono essere ricondotti al nome latino PARUM - AFFINI (paraffine), che indica una scarsa reattività. Ci sono tuttavia due reazioni degli alcani sulle quali ci si deve soffermare: CLORURAZIONE e COMBUSTIONE
Se si carica con i due gas, metano e cloro, un recipiente di vetro ricoperto da carta stagnola, non avviene alcuna reazione, nonostante i dati termodinamici [25] la presentino come reazione altamente spontanea e favorita.
![]()
![]() CH3 - H +
Cl - Cl → CH3 - Cl + H - Cl ΔG=
-25Kcal/mol
CH3 - H +
Cl - Cl → CH3 - Cl + H - Cl ΔG=
-25Kcal/mol
K = 1018 ( spostata a destra)
[25] .
Tolta la stagnola, si illumina con luce ultravioletta, assistendo così ad una reazione repentina e quasi esplosiva; la luce ha cioè esercitato il suo effetto catalitico facendo decorrere la reazione attraverso i seguenti stadi .
![]()
![]() alla luce il legame si rompe in parti uguali
si chiama OMOLITICA
alla luce il legame si rompe in parti uguali
si chiama OMOLITICA
![]()
![]()
![]()
![]() Cl . Cl 2Cl
Cl . Cl 2Cl
Le due particelle che sono rimaste sono uguali e sono 2 atomi di Cl definite radicali cloro.
[27]
![]()
![]()
![]() CH4 Cl CH3 + HCl
CH4 Cl CH3 + HCl
![]()
![]() Proazione
della
Proazione
della
torna in ciclo catena.
![]() . CH3 + Cl2 CH3Cl + Cl
. CH3 + Cl2 CH3Cl + Cl
[27] e [28] si ripetono finché il radicale cloro e un radicale metile non si uniscono.
In [26] si ha la rottura omolitica del legame Cl - Cl con
formazione del radicale Cl
. (radicale = atomo o raggruppamento di atomi con un
elettrone spaiato ) che in [27] strappa H
. al metano formando il radicale
metile che in [28] ripristina il radicale Cl
. producendo il CLORURO DI METILE; la sequenza di [27] e [28] si ripete
a catena .
Alla fine della reazione si trovano:
![]()
![]()
![]()
![]() CH4 CH3Cl CH2Cl2 CH Cl3 CCl4
CH4 CH3Cl CH2Cl2 CH Cl3 CCl4
miscelati tra loro in quanto il Cl
. ha la possibilità di
strappare H
. non solo a CH4 , ma anche a CH3Cl e
così via. Gli estremi hanno caratteristiche differenti CH4
ottimo combustibile mentre CCl4 si usava come liquido degli
estintori. La reazione costituisce un esempio di reazione di SOSTITUZIONE
La combustione è la reazione per cui un idrocarburo si ossida rapidamente e completamente, ad alta temperatura, ad anidride carbonica ad H2O; è un processo esotermico che, se avviene a pressione costante("a cielo aperto"), viene valutato attraverso il valore di ΔH . Per la combustione del metano [29] si ha un valore sperimentale in buon accordo con quello calcolabile dai valori tabulati dell'energia di legame.
C - H 99 Kcal/mole
O = O 119 Kcal/mole
C = O 192 Kcal/mole
O - H 111 Kcal/mole
|
Rottura |
4 legami |
C - H |
|
|
Kcal/mole |
|
Rottura |
2 legami |
O = O |
|
|
Kcal/mole |
|
Formazione |
2 legami |
C = O |
|
|
Kcal/mole |
|
Formazione |
4 legami |
O - H |
|
|
Kcal/mole |
|
|
|
|
|
-l94 |
Kcal/mole |
![]() CH4
+ 2 O2 CO2
+ 2H2O
CH4
+ 2 O2 CO2
+ 2H2O
ΔH sperimentale = -l92 Kcal/mol
Le calorie per demolire i legami CH e la molecola O2 sono assorbite, mentre le altre sono liberate. Questa reazione sviluppa energia.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta