| chimica |
|
Equilibrio chimico
Molte reazioni chimiche possono avvenire nei due sensi, cioè i ruoli dei reagenti e dei prodotti possono scambiarsi fra di loro. Reazioni di questo tipo si chiamano reversibili. Le reazioni per le quali questo non avviene sono dette irreversibili. Molto spesso, nelle reazioni reversibili, man mano che si formano dei prodotti, questo cominciano a dar luogo alla reazione inversa. Le due reazioni avvengono, quindi, contemporaneamente.
Quando le velocità delle due reazioni diventano uguali, i reagenti che si trasformano in prodotti sono esattamente compensati dai prodotti che si trasformano in reagenti; le concentrazioni dei prodotti e dei reagenti rimangono costanti. I queste condizioni si dice che la reazione ha raggiunto l'equilibrio. Dall'esterno sembra che la reazione si sia fermata , perché non si notano variazioni,; infatti, le due reazioni procedono simultaneamente con velocità uguale, si tratta di un equilibrio dinamico. Quando le reazioni chimiche sono reversibili dovremo perciò usare una doppia freccia e scrivere
![]()
Questo comporta che dai prodotti si possa ottenere i reagenti; in realtà avremo, quando il sistema si sarà stabilizzato, quando cioè sarà all'equilibrio, una situazione in cui saranno presenti tutti i componenti, ognuno con una concentrazione che non cambia nel tempo (sempre che non cambino i parametri: pressione p, numero di moli dei singoli componenti n, temperatura T).
I sistemi in equilibri tendono a mantenere questa situazione. Se si agisce su un sistema in equilibrio con una qualche azione di disturbo dall'esterno il sistema reagisce i modo da contrastare questa azione. Questo si basa sul:
Principio di Le Chatelier il quale dice che quando un sistema è all'equilibrio, sistema endocrino si modificano dall'esterno uno o più fattori che caratterizzano questo equilibrio, il sistema reagisce in modo da opporsi alla modificazione fatta, e si sposta verso un nuovo equilibrio che tende apparato digerente annullare gli effetti della modificazione stessa.
I fattori da cui dipende l'equilibrio chimico sono:
natura dei reagenti e prodotti
concentrazione dei reagenti e prodotti
temperatura
pressione
Costante all'equilibrio
Poiché all'equilibrio le concentrazioni dei componenti sono costanti, sarà costante anche un loro rapporto. La legge che regola le condizioni di equilibrio è detta:
Legge dell'azione di massa Nella forma applicabile a reazioni che avvengono in un unica fase (reazione in fase omogenea) essa dice che: A temperatura e mezzo costanti, il prodotto fra le concentrazioni dei prodotti della reazione all'equilibrio, ciascuno elevato ai rispettivi coefficienti stechiometrici, diviso il prodotto delle concentrazioni dei reagenti ,ciascuno elevato ai rispettivi coefficienti stechiometrici, è una costante. (nel senso che se modifico la concentrazione di un componente, automaticamente si modificano le altre in modo che il rapporto generale Kc resti costante).

Gli esponenti sono i rispettivi coefficienti stechiometrici. La costante Kc viene chiamata costante di equilibrio ed è una costante termodinamica; dipende solo dalle sostanze in equilibrio e dalla T del sistema; il simbolo 'c' è dovuto al fatto che essa è espressa mediante le concentrazioni (mol dm-3).
Il valore di Kc è ovviamente costante, ma esso rappresenta la costante di equilibrio solo quando il sistema è effettivamente all'equilibrio; prima del raggiungimento esprime la legge dell'azione di massa.
Queste espressioni dell'azione di massa ci permettono di calcolare come variano le concentrazioni degli altri componenti del sistema se variamo la concentrazione (o la pressione o il numero di moli ) di uno di essi (sempre però a T costante).
Quando si tratta di gas, si usano spesso le pressioni parziali anziché le concentrazioni (basta ricordare che, per la legge di Dalton sulle miscele gassose ideali, la pressione è proporzionale a numero di moli); otterremo, in questo caso, una Kp.
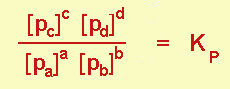
Correlazione tra Kp e Kc
Kc=Kp (RT)(c+d-a-b)
Kp = Kc solo quando non c'è variazione tra il numero di moli dei reagenti e quella dei prodotti. ( T = temperatura; R=costante)
Usi della costante di equilibrio
La costante di equilibrio ha interessanti usi:
se K >> 1 allora saranno favoriti i prodotti
se K ![]() 1
allora né i reagenti né i prodotti saranno favoriti
1
allora né i reagenti né i prodotti saranno favoriti
se K << 1 allora i reagenti saranno favoriti
Leggere << e >> rispettivamente molto minore e molto maggiore
Conoscendo il valore K, la concentrazione iniziale dei reagenti e la temperatura si può prevedere la concentrazione all'equilibrio.
Impostando un valore Q, quoziente di reazione, con le concentrazioni conosciute, è possibile sapere, confrontandolo con la costante di equilibrio K, il verso che prenderà la reazione:
se Q < K allora i reagenti sono più di quanto sono necessari all'equilibrio, la reazione tende a spostarsi verso destra
se Q > K allora saranno i prodotti in eccedenza, quindi la reazione si sposterà a sinistra.
se Q = K allora i prodotti e i reagenti sono in equilibrio.
Si parla:
Equilibri eterogenei quelli in cui le sostanze coinvolte si trovano in stati fisici diversi: alcuni allo stato gassoso, altra allo stato solido. In questo caso le concentrazioni delle sostanze allo stato solido sono costanti quindi queste concentrazioni vengono inglobate nella costante di equilibrio
Equilibri omogenei sono quelli in cui occorre tener conto di tutti i componenti.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta