| chimica |
|
|||||
|
q Introduzione
q Numero di Ossidazione
q Analisi di una reazione red-ox
q Criteri per il decorso spontaneo
q Regole di Bilanciamento
q Elettrochimica e Celle Elettrochimiche
q Pila Daniell
q Equazione di Nerst
q Potenziali di Elettrodo
q Spontaneità di una reazione red-ox
q Elettrolisi
Cosa sono le reazioni di Ossido-Riduzione
![]()
sono quelle reazioni in cui almeno un atomo aumenta il numero di ossidazione (N.O.) ed un altro lo diminuisce passando dai reagenti ai prodotti.
sono abbreviate anche in reazioni redox
Esempio:

Lo Zinco ha aumentato il N. O.
Il Rame ha diminuito il N. O.
F Il cambiamento del numero di ossidazione di un atomo implica che tali reazioni avvengono formalmente mediante trasferimento di elettroni da un atomo ad un altro
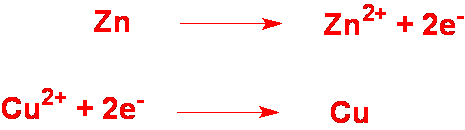
Gli elettroni perduti dallo zinco sono acquistati dal rame
Zn2+/Zn, Cu2+/Cu sono dette coppie redox
Ossidante è una sostanza capace di acquistare elettroni. Diminuisce il N.O. passando dai reagenti ai prodotti; si dice che si riduce
Riducente è una sostanza capace di cedere elettroni. Aumenta il N.O. passando dai reagenti ai prodotti; si dice che si ossida
In una reazione red-ox c'è sempre un atomo che si ossida ed uno che si riduce (due coppie red-ox)
L'incremento del N.O. nel passare dai reagenti ai prodotti, corrisponde al processo di ossidazione; la diminuzione del N.O. corrisponde ad una riduzione
Una reazione Red-Ox avviene quando l'ossidante e il riducente che reagiscono formano un ossidante ed un riducente più deboli (coppia red-ox)
![]() Forza Ossidante Soluzione acida Forza Riducente
Forza Ossidante Soluzione acida Forza Riducente
|
|
Li |
|
K+ |
K |
|
Na+ |
Na |
|
Al3+ |
Al |
|
Zn2+ |
Zn |
|
Fe2+ |
Fe |
|
H+ |
H2 |
|
H2SO4 |
SO2 |
|
Cu2+ |
Cu |
|
I2 |
I- |
|
Ag+ |
Ag |
|
Hg2+ |
Hg |
|
NO3- |
NO |
|
Cr2O72- |
Cr3+ |
|
Au3+ |
Au |
|
MnO4- |
Mn2+ |
|
F2 |
F- |
Assegnare il numero di ossidazione a tutti gli elementi, identificando le specie che si ossidano e che si riducono
Calcolare il numero di elettroni persi e acquistati dalle coppie redox
Bilanciare il numero di elettroni scambiati facendo in modo che: n° e- persi dal riducente sia uguale al n° e- acquistati dall'ossidante
Bilanciamento delle cariche (H+ se soluzione acida o OH- se soluzione basica)
Bilanciamento delle masse
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta