Temperatura
Grandezza fisica che caratterizza lo stato termico di un corpo o di un sistema termodinamico e che trae origine
dalle sensazioni di caldo e di freddo. Temperatura
assoluta, scala della temperatura definita
mediante un gas perfetto o un ciclo termodinamico reversibile. (Lo zero di
questa scala coincide con lo zero assoluto.)
La temperatura è una grandezza fisica fondamentale che interviene nella
descrizione dei fenomeni termici e che viene definita operativamente mediante
un criterio di misura. Per comune esperienza si sa che un corpo caldo e uno
freddo posti a contatto tra loro e isolati dagli altri corpi appaiono, dopo un
certo tempo, ugualmente caldi; questo fenomeno è dovuto a una cessione
di calore dal corpo più caldo a quello più freddo che si arresta
quando i due corpi raggiungono uno stato di equilibrio, detto equilibrio
termico. Due corpi in equilibrio termico tra loro si dicono
nello stesso stato termico. Si può pensare di ordinare idealmente
i corpi in base al loro stato termico in modo che ogni corpo sia più
caldo del
corpo che lo precede (cioè possa cedergli spontaneamente una
quantità di calore). Per ottenere una valutazione più precisa
dello stato termico di un corpo occorre associare a
esso un numero che rappresenti la misura di una grandezza fisica che
caratterizza lo stato termico, detta per definizione temperatura. Uno stesso
corpo può assumere ovviamente diversi stati termici: basta infatti
metterlo a contatto con corpi in stati termici diversi. Si osserva sperimentalmente
che di solito un corpo quando passa da uno stato
termico più freddo a uno più caldo aumenta il proprio volume; si
può allora assumere il valore di questa dilatazione come misura della
differenza di temperatura tra i due stati termici. Utilizzando un corpo come
campione e ponendolo successivamente in equilibrio termico con diversi corpi si
può ottenere una misura della differenza tra gli stati termici in cui
questi corpi si trovano: naturalmente occorre che il corpo campione abbia una
massa molto minore di quella dei corpi in esame per evitare che l'operazione di
misura alteri sensibilmente lo stato termico del corpo. In pratica si procede
nel modo seguente: il corpo campione, o sostanza termometrica (per es.
mercurio), contenuto in un recipiente di forma cilindrica (termometro), viene
posto in equilibrio con due stati termici ben individuati e facilmente
riproducibili a cui si attribuiscono due determinati valori della temperatura
(temperatura di riferimento): per es. si associa il
valore 0 della temperatura allo stato termico del ghiaccio fondente e il valore 100 allo
stato termico dell'acqua bollente a pressione normale. In
corrispondenza di questi due stati termici la colonna di mercurio raggiunge due
diversi livelli. Dividendo in cento parti uguali (gradi Celsius o
centigradi) l'intervallo compreso tra questi due livelli e prolungando la
suddivisione al di sopra e al di sotto delle temperature di riferimento si
costruisce così una scala termometrica (scala empirica delle temperature) che consente di attribuire un
determinato valore della temperatura a ogni stato termico che può essere
in equilibrio con il mercurio liquido. Naturalmente il
valore o la scelta delle temperature di riferimento e il numero delle
suddivisioni dell'intervallo tra queste temperature è arbitrario e
dipende unicamente dalle convenzioni adottate. La definizione operativa di
temperatura precedentemente accennata si basa sull'impiego di una sostanza
termometrica; questo metodo presenta delle difficoltà di carattere
concettuale in quanto sostanze diverse hanno un
comportamento diverso agli effetti della dilatazione termica, perciò il
valore della temperatura di uno stato termico dipende in generale dal tipo di
sostanza termometrica utilizzata. Per superare questa difficoltà si
può utilizzare come sostanza termometrica un gas perfetto, cioè in
pratica ogni gas molto rarefatto; infatti un gas nelle condizioni di gas
perfetto ha un comportamento termico indipendente dalla natura chimica del gas. L'utilizzazione
del gas perfetto come
sostanza termometrica ha inoltre il vantaggio di consentire di definire un
valore minimo della temperatura: infatti dall'equazione di stato del gas perfetto si deduce che il volume del gas diminuisce con
la temperatura fino ad annullarsi. Il valore della
temperatura per cui il volume del
gas perfetto si annulla è per definizione lo zero assoluto. Nella scala Celsius la temperatura t dello zero assoluto corrisponde a 273,15 ºC.
Scegliendo lo zero assoluto come valore zero della temperatura e lasciando
invariata la suddivisione in gradi centigradi, cioè ponendo T = t + 273 , si
ottiene una nuova scala, detta scala
delle temperature assolute o scala
Avogadro; la sua unità di misura è ancora il °C, tuttavia si
indica di solito tale unità con il nome di Kelvin (simb.: K) perché essa
coincide con l'unità di misura Kelvin della scala termodinamica delle temperature assolute. In questa scala la
nozione di temperatura è definita in maniera indipendente da ogni
sostanza termometrica e si basa sulla constatazione, dovuta a lord Kelvin, che
il rendimento di una macchina termica che compie un ciclo di Carnot (o un altro ciclo
reversibile) non dipende dalla sostanza che subisce la trasformazione
termodinamica, ma unicamente dallo stato termico dei due termostati tra i quali
avviene il ciclo. Precisamente detta Q1 la quantità di calore scambiata
con il primo termostato e Q2 la quantità di
calore scambiata con il secondo termostato si ha, in base al secondo principio
della termodinamica,
Q1/Q2=
Q t Q(t2)
dove Q(t) è un'opportuna funzione della temperatura empirica dei
termostati, ossia della temperatura misurata con una qualsiasi sostanza
termometrica. Si può allora introdurre una nuova scala delle
temperature, detta appunto scala termodinamica, usando come temperatura la
stessa funzione Q t) che è univocamente determinata se si conoscono le
quantità di calore Q1 e Q2 e si stabilisce che la differenza tra la
temperatura dell'acqua bollente e quella del ghiaccio fondente sia pari a 100
K. Con queste convenzioni risulta Q(t) = T dove T è la temperatura
assoluta definita mediante il gas perfetto. Nel sistema SI il grado Kelvin
è fissato stabilendo che sulla scala termodinamica delle temperature
assolute la temperatura del punto triplo
dell'acqua sia 273,16 K: con questa scelta la
temperatura del
ghiaccio fondente a pressione normale corrisponde a 273,15 K circa in accordo
con la scala Avogadro. La teoria cinetica dei gas consente di interpretare la
temperatura, introdotta in termologia come una grandezza fisica fondamentale,
come un indice dello stato meccanico medio delle
molecole: si dimostra che la temperatura assoluta T è proporzionale
all'energia cinetica media u delle
molecole:
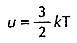
dove k è la costante
di Boltzmann; tale formula può essere utilizzata per estendere il
concetto di temperatura a sistemi statistici in equilibrio.
v Basse temperature
Il limite inferiore delle temperature tecnicamente raggiunte, che
non può essere 0 K per il terzo principio della termodinamica o ipotesi
di Nerst-ck, è stato ulteriormente abbassato. Le ultime tappe sono
state le seguenti:
K, mediante
ebollizione di elio liquido a una pressione di 3,6 mmHg;
K, mediante
soluzione dell'elio 3 nell'elio 4, realizzato nelle condizioni di
superfluidità (Dubna, 1969);
K, mediante
raffreddamento magnetico cui è stato sottoposto un campione di 130
grammi di rame.
L'interesse della
realizzazione di temperature così basse è legato sia allo studio
delle proprietà della materia in tali condizioni, sia alle possibilità
di applicazione di tali proprietà (ad es. per i superconduttori).
v Alte temperature
Prescindendo
dalle reazioni esplosive, nelle quali la temperatura può
raggiungere 50.000 K, per intervalli di tempo assai brevi, nelle reazioni di
combustione si possono raggiungere temperature dell'ordine di 2.000 K nei
forni, di 3.000÷4.000 K all'interno di certe fiamme. Dopo il
1950 l'impiego del
plasma ha consentito di raggiungere temperature assai più alte; ad es. nei cannelli al plasma ad alta frequenza si raggiungono
circa 50.000 K, utilizzabili per varie applicazioni: taglio di metalli come
l'alluminio, trattamento termico dei materiali più refrattari, studio
dei motori nelle condizioni di volo supersonico. Temperature ancora più
elevate, di decine di milioni di K, raggiunte durante
l'esplosione di bombe nucleari, sono ottenute in qualche laboratorio per lo
studio della fusione nucleare controllata, sia mediante laser di grande potenza, sia mediante
l'azione di un campo magnetico su plasma. Tali temperature, superate
permanentemente durante le reazioni di fusione
nucleare che hanno luogo negli ammassi stellari, sono raggiunte in laboratorio
per durate estremamente brevi in spazi estremamente ridotti.
![]()