| biologia |
|
ANALISI DELLE ACQUE DESTINATE AL CONSUMO UMANO
Le acque, soprattutto quelle superficiali, possono essere contaminate da impurità come i liquami domestici e gli scarichi industriali. Se i sistemi di smaltimento non funzionano adeguatamente, le acque contaminate, possono raggiungere le falde acquifere e causare effetti negativi legati proprio alla presenza di microrganismi di origine fecale.
Con un analisi batteriologica cerchiamo, in un campione di acqua del fiume Chioma(vicino Livorno), la presenza o meno dei batteri patogeni, dai quali dipende l'inquinamento delle acque.
Per prelevare l'acqua utilizziamo flaconi
di vetro incolore perfettamente puliti, asciutti, sterilizzati e muniti di
tappo; è importante che rimangano chiusi fino al momento del prelievo. I
flaconi devono essere riempiti per tre quarti e immediatamente chiusi; inoltre
per effettuare correttamente il riempimento di questi flaconi occorre volgere
l'imboccatura in senso opposto alla corrente dell'acqua. Una volta pieni vanno
trasportati in contenitori refrigerati a
Per risalire alla presenza di batteri patogeni nell'acqua andiamo a ricercare quelli non patogeni, seguiamo cioè un metodo indiretto; nel materiale fecale infatti, insieme ai batteri patogeni è presente anche una grande quantità di batteri non patogeni. questi ultimi vengono detti indicatori di inquinamento. Coltivando su opportuni terreni di coltura questi microrganismi non pericolosi possiamo risalire anche ai batteri patogeni contenuti nei campioni di acqua prelevati. Come indicatori nella nostra prova useremo i batteri fecali perchè hanno la caratteristica di essere sempre presenti e abbondanti nelle feci e soprattutto facilmente svelabili. Ricordiamo fra questi indicatori gli streptococchi fecali e gli escherichia coli, degli enterobatteri.
La famiglia degli enterobatteri è formata da batteri che naturalmente vivono nell'intestino umano. Tutti questi batteri hanno caratteristiche antigeniche e biochimiche uguali: tutti gli enterobatteri sono bacilli gram- negativi; possono essere mobili o immobili, ma tutti sono provvisti di pili; sono aerobi o anaerobi facoltativi e possono svilupparsi in normali terreni di coltura. In ambiente privo di ossigeno, attraverso la fermentazione, possono anche utilizzare il glucosio producendo acidi e gas. Microscopicamente si presentano come bacilli della grandezza di 1.1,6micron x 2.7micron, di solito singoli, talvolta accopiati.
I caratteri antigeni degli enterobatteri si dividono in quattro categorie:
antigeni
O o somatici: sono quelli delle
membrane esterne, responsabili dell'attività enterotossica
dei bacilli gram -. Sono termostabili
fino a
Antigeni
H o flagellari: sono gli antigeni
localizzati nei flagelli dei batteri mobili. Sono di natura proteica e vengano
inattivati dal calore (
Antigeni
K o capsulari: sono gli antigeni che
circondano quelli somatici(O) negli stipiti cellulari, sono di natura polisaccaridica e distruttibili dal calore a
Antigeni delle fimbrie: i batteri che possiedono numerosi pili sono agglutinati dai sieri specifici con un tipo di agglutinazione simile a quella degli antigeni H. Talvolta sono così abbondanti da mascherare gli antigeni O impedendo la capacità di reazione con i sieri specifici; questo problema può però essere risolto con la bollitura.
Anche i caratteri biochimici possono essere suddivisi in quattro categorie:
_ utilizzo di alcuni substrati come fonte di carbonio
_ presenza di enzimi
_ prodotti del metabolismo specifici
_ capacità di fermentare alcuni zuccheri.
I caratteri biochimici servono quando andiamo a ricercare gli indicatori di contaminazione nel campione di acqua, perché per poter effettuare il conteggio MPN, le specie da sottoporre a conteggio devono essere svelabili per almeno una di queste caratteristiche (ad esempio, nel caso dell'e-coli, la caratteristica svelabile è l'utilizzazione del lattosio con produzione di gas).
Il conteggio MPN è un metodo statistico che consiste in una prova presuntiva che andrà successivamente confermata con altre dette appunto prove di conferma. Prima di tutto è importante standardizzare le condizioni di sviluppo, cioè bisogna fornire le medesime condizioni di crescita al variare delle condizioni di semina. Con questo conteggio si può risalire al numero più probabile di batteri presenti in 100ml di campione confrontando i valori ottenuti dall'esperienza con quelli di una tabella ministeriale pubblicata in un decreto. Da questi valori si può poi stabilire se un campione di acqua è potabile o no, dato che le acque destinate al consumo umano non devono superare dei valori limite ben precisi. I valori guida indicati devono essere considerati come valori ottimali a cui si deve tendere. Secondo la normativa il valore limite di coliformi fecali presenti nell'acqua è 0, mentre per quelli totali è 5 anche se viene specificato che la presenza di coliformi fa comunque ritenere l'acqua sospetta.
La prova presuntiva si effettua usando, come terreno in fase liquida, il brodo lattosato, perché contiene lattosio, usato appunto dagli e-coli nella fermentazione con la produzione di gas, e, come campione da analizzare, l'acqua del Chioma. Lavorando sotto cappa, introduciamo:
_10 ml di campione in 5 provette provviste di campanella di Duram, dove aggiungiamo anche 10 ml di brodo lattosato a doppia concentrazione;
_altri 50 ml di campione in una beutina, anch'essa provvista di campanella, con altri 50 ml di brodo.
Ora che la semina è stata fatta, incubiamo tutto a
A questo punto dobbiamo confermare questo risultato con due prove: una per i coliformi totali e una per quelli fecali. Per fare tutte e due queste prove useremo le provette positive alla prova presuntiva.
Per quanto riguarda la conferma dei coli totali, utilizziamo
come terreno il brodo bile verde
brillante (BBVB): un terreno selettivo che inibisce lo sviluppo di tutti i
batteri tranne i coli, e ne mettiamo 10 ml in ognuna delle 5 provette, a cui
aggiungiamo anche 0,5ml presi da ogni provetta positiva e dalla beuta. Questa operazione
è un'operazione di trapianto e va eseguita con micropipette
sterili; ricordiamo anche di aggiungere una campanella di Duram
in ogni provetta. Incubiamo per 24/48 ore a
Prova di conferma coliformi fecali
Per la prova di conferma dei coliformi fecali usiamo
invece un altro tipo di terreno, l'E.Coli Broth (ECBroth), che ha composizione simile al brodo lattosato. Inseriamo sempre 10ml d terreno nelle 5
provette, provviste di campanella di Duram, e ci aggiungiamo
0,5 ml di ogni provetta positiva e 0,5 ml della beuta; il tutto sempre con micropipette sterili. Questa volta però incubiamo
per 24 ore a
Per identificare i tipi di enterobatteri presenti nel campione, l'esame microbiologico è di scarsa utilità, in quanto questi batteri non possono essere distinti da altri batteri gram- e tanto meno possono essere distinti fra di loro, per tanto, particolare importanza, viene assunta dall'esame colturale. Dato che molti dei materiali inviati per ricerche batteriologice contengono più specie batteriche, è opportuno in generale usare terreni selettivi per facilitare l'isolamento delle varie specie di enterobatteri dagli altri microrganismi. I terreni selettivi adatti all'isolamento contengono sostanze inibenti la crescita di gram+ e di alcuni gram- non appartenenti a quella famiglia. I terreni selettivi da noi utilizzati per questo scopo sono: agar Mac-conkey; agar Eosina blu di metilene; agar Endo; agar Ss; agar Hektoen.
L'agar Mac-conkey è un terreno solido differenziale per l'isolamento selettivo dei batteri gram negativi. I Sali biliari ed il cristalvioletto inibiscono la crescita dei batteri gram+ e di alcuni gram- esigenti. In questo terreno troviamo lattosio,come unico carboidrato, e il rosso neutro, cm indicatore del ph.
Le colonie di stipiti batterici che fermentano lattosio, con forte produzione di acido(e-coli) assumono un colore rosso scuro e possono essere circondate da un alone di precipitazione dei Sali biliari. Gli stipiti del genere salmonella e shighella, che non fermentano il lattosio, non apportano modificazioni evidenti e le colonie si presentano trasparenti. Gli stipatici batterici che producono debolmente acido dal lattosio formano colonie di colore rosa più o meno chiaro alla periferia e con il centro colorato in rosa.
L'agar eosina blu di metilene(emb) è un terreno solido differenziale per l'isolamento dei batteri coliformi da campioni con flora batterica mista. I coloranti di anilina, eosina e blu di metilene, inibiscono i batteri gram+ ed i batteri gram- esigenti; inoltre si combinano a ph acido formando un precipitato e fungendo così da indicatori della produzione di acido. Anche in questo terreno l'unico carboidrato presente è il lattosio. I forti fermentati il lattosio formano colonie con aspetto metallico e di colore verde nero. i deboli fermentati producono colonie color porpora e i non fermentati il lattosio formano colonie trasparenti.
L'agar Endo è un terreno solido impiegato per isolare i coliformi da alimenti come acqua, latte ed altri generi alimentari. Il solfito di sodio e la fucsina basica servono ad inibire la crescita dei batteri gram+. La produzione di acido da lattosio(unico carboidrato) non viene evidenziata in base alla variazione del ph, ma per la reazione del prodotto intermedio, l'acetaldeide, che viene fissata al solfito di sodio. Le colonie che fermentano lattosio presentano un colore che va dal rosa al rosso. I forti produttori di acidi(e-coli) possono colorare il terreno intorno alle colonie,o produrre una lucentezza metallica per reazione con la fucsina basica. I microrganismi che non fermentano lattosio(salmonella e shigella) producono colonie che presentano quasi lo stesso colore del terreno.
Terreni più selettivi sono necessari per la ricerca di salmonelle e shigelle nelle feci di individui effetti da forme di gastroenterite. L'uso di questi mezzi di coltura permette infatti di evidenziare più facilmente in questo materiale, contenente un' altissima concentrazione di enterobatteri, queste due specie patogene anche quando sono presenti in quantità ridotte. I più comuni terreni formulati a questo scopo sono l'agar salmonella-schigella (ss) e l'agar hektoen enteric (he)
L'agar ss, per il suo alto contenuto in Sali biliari e citrato di sodio, oltre ad inibire i gram+ e i gram- più esigenti, inibisce anche la maggior parte dei coliformi. I lattosio è l'unico carboidrato e il rosso neutro è l'indicatore per evidenziare la produzione di acido. A differenza dei terreni descritti in precedenza, contiene anche il triosolfato di sodio e citrato di ferro che rendono possibile la evidenziazione degli stipiti produttori di H2S secondo la seguente reazione:
Na S O à H S + Fe à FeS + H
Il triosolfato di sodio viene ridotto dalle ss in acido solfidrico che, in presenza di ferro, dà luogo alla formazione di solfuro ferroso, di colore nero, con sviluppo di gas.
in questo terreno i batteri fermentati lattosio formano colonie di colore rosso;le salmonella formano colonie incolori con una zona centrale nera più o meno evidente secondo la quantità di h2s prodotto;le schigelle vengono variamente inibite e le colonie appaiono incolori senza centri neri.
L'agar he, come l'agar ss , contiene un' elevata concentrazione di Sali biliari come sostanza inibitrice i gram+ e i coliformi. A differenza dell'agar ss contiene come carboidrati lattosio, saccarosio e salicina e, come indicatore di ph, il bleu di bromotimolo che vira al giallo in ph acido in presenza di fucsina. Per l'evidenziazione della produzione di H2S, contiene il triosolfato di sodio e citrato di ferro. I rapidi fermentanti sono moderatamente inibiti e producono colonie di colore variabile dall'arancio brillante al rosa salmone. Le colonie di salmonella appaiono blu verdi con tipici centri neri dovuti all'H2S. Le schigelle appaiono più verdi delle salmonelle con il colore che si attenua alla periferia della colonia.
Per preparare tutti questi terreni occorre rispettare la proporzione che ricaviamo leggendo le informazioni sulla confezione di ogni terreno. Nel nostro caso ne dobbiamo preparare circa 200ml per ogni tipo, da inserire in 13 provette( circa 15 ml di terreno in ognuna). Siccome tutti questi terreni sono agar, non s sciolgono bene con l'acqua, ma vanno scaldati almeno fino a 80 gradi su un becco bunsen. Per quanto riguarda l'agar ss e he è bene ricordare che vanno preparati solo al momento dell'utilizzo.
La semina viene fatta con la tecnica detta a disseminazione in superficie che permette di realizzare successive diluizione del campione e di ottenere uno sviluppo di colonie fra loro distanziate. In questo modo si ottengono colonie originatesi da una sola cellula e quindi, se il campione presenta più specie microbiche, si può ottenere una loro separazione. le colonie sono infatti insiemi di milioni di cellule e s distinguono, secondo le specie che le ha prodotte, per la forma, le dimensioni ed il colore.
Nel nostro caso la semina è stata eseguita per triplo striscio, simile alla disseminazione in superficie, che però permette di differenziare ed isolare maggiormente le colonie per evitare che si formi una patina che potrebbe coprire completamente, o quasi, la superficie della piastra.
La semina (o trapianto) nei terreni solidi come questi, avviene in tale modo, ovviamente sempre in condizioni sterili: si impugna con una mano un'ansa o una spatola o un tampone sterili e si preleva una piccola quantità di campione; con l'altra mano si solleva il coperchio della piastra petri e, si appoggia ad un estremità la piccola quantità del campione prelevato. Ora si procede alla vera semina partendo dalla zona in cui si è deposto il campione e, continuando a zig zag (andando da un lato all'altro della piastra), si arriva circa fina e metà della piastra. A questo punto cambiamo verso dello zig zag e raggiungiamo la metà della metà piastra rimasta vuota. L'ultima metà la strisciamo riprendo il verso iniziale dello zigzag.
Semina per triplo striscio
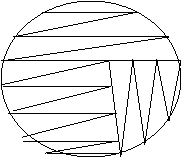
Dopo la semina avviene l'incubazione il cui tempo e temperatura può variare a seconda della specie da coltivare, ma che in genere è di 37° per 24-48 ore. Se il terreno solido s prepara con l'agar l'incubazione si effettua con le capsule petri tenute capovolte, per evitare che il terreno si essicchi per evaporazione e l'acqua di condensazione impedisca l'osservazione delle colonie.
Risultati
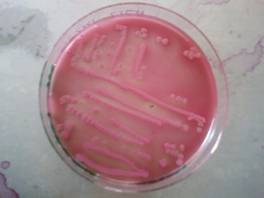
Nel mac conkey osserviamo colonie di colore rossastro circondate da aloni chiari di precipitazioni dei Sali biliari( in seguito all'acidificazione) dovute alla presenza d batteri fermentati il lattosio. Sono presenti quindi e-coli.
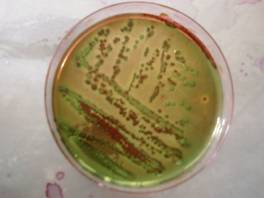
Nell'emb notiamo la formazione di varie colonie con centro nero una lucentezza metallica diffusa. si notano anche alcune colonie color porpora. Sono quindi presenti e-coli e alcuni deboli fermentanti.
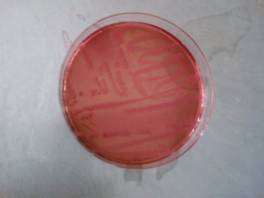
Nell'agar endo vediamo la formazione di molte colonie di colore rosa-rosso che evidenziano la presenza di e-coli.
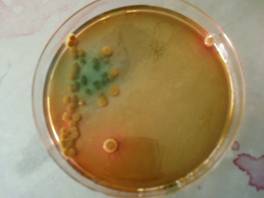
Nel terreno dell'agar he vediamo che si sono formate alcune colonie che hanno una leggera colorazione sull'arancio/rosa salmone e una parte invece che hanno una colorazione sul verde e sono più piccole. Sono quindi presenti e-coli e forse anche alcuni non fermentanti il lattosio.
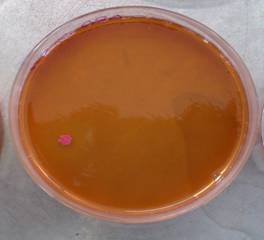
Nell'agr ss si nota la formazione di una sola colonia con colorazione rosa. Sono forse presenti piccolissime quantità di e.coli.
Relazione di laboratorio di biologia classe 4°liceo scientifico tecnologico
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta