| biologia |
|
GLI ENZIMI
1) Definizione - Gli enzimi sono sostanze proteiche ad elevato peso molecolare, colloidali, più o meno tremolabili, dotati di capacità catalitiche e la cui azione non è strettamente legata all'attività vitale (= in vitro).
2) Funzione - Gli enzimi attivano un meccanismo di catalisi, cioè rendono più rapido il raggiungimento dell'equilibrio chimico della reazione, operando in modo altamente specifico. La loro capacità catalitica è misurata dal numero di turnover, cioè dal numero di molecole di sostanza chimica convertita in prodotto in un secondo da ogni molecola di enzima in condizioni ottimali.
3) Nomenclatura - Inizialmente agli enzimi furono assegnati nomi di fantasia (in genere terminanti con la desinenza -ina, poiché di natura proteica: pepsina, amilopsina, chimosina, ecc.). Con la scoperta di un numero sempre maggiore di enzimi si è reso necessario adottare una terminologia basata su regole precise. Poiché ogni enzima è specifico per il substrato su cui agisce e per l'azione chimica svolta, esso è individuato dal nome del substrato e dall'azione svolta terminante con la desinenza -asi (substrato-azione-asi): per esempio, la lattatodeidrogenasi agisce sull'acido lattico sottraendo ioni H+.
4)Classificazione - Gli enzimi possono classificarsi secondo diversi criteri.
a) Struttura chimica - Questo tipo di classificazione non è molto importante dal punto di vista biologico, in quanto la composizione chimica degli enzimi è molto varia.
b) Ubicazione - In base al luogo in cui gli enzimi operano, si possono suddividere in endocellulari (la maggior parte, come gli enzimi respiratori) ed esocellulari (enzimi dei succhi digestivi, enzimi delle lacrime).
c) Sede cellulare - Gli enzimi endocellulari, a loro volta, si possono classificare in base al sito cellulare in cui operano: mitocondri (enzimi respiratori), cloroplasti (enzimi del ciclo di Calvin), nucleo (duplicazione del DNA, sintesi dell'mRNA), RE ruvido (sintesi proteica), ecc.
d) Presenza - Possono essere costitutivi (se sono sempre presenti all'interno della cellula) o adottivi (se sono presenti solo a contatto col substrato).
e) Reazione catalizzata - Dal punto di vista biochimico è la classificazione più importante. Si dividono in:
Ossidoreduttasi: catalizzano reazioni di ossidoriduzione in cui si scambiano O, H e/o elettroni tra due molecole (citocromossidasi della catena di trasporto degli elettroni nella respirazione aerobica).
Transferasi: catalizzano il trasferiscono gruppi funzionali, come NH2, COOH, H3PO4 da una molecola all'altra (transamminasi, decarbossilasi, fosfofruttocinasi).
Idrolasi: operano l'idrolisi di una molecola, cioè la sua scissione con l'impiego di una molecola di H2O (maltasi, che scinde il maltosio in 2 molecole di glucosio: C12H22O11 + H2O 2C6H12O6).
Liasi: determinano la rottura non ossidativa e non idrolitica di vari legami (come C-C, C-O, C-N), l'eliminazione di gruppi con formazione di doppi legami, l'addizione di gruppi a doppi legami (fosfoenolpiruvato carbossicinasi nella fermentazione alcolica).
Ligasi: provocano la condensazione di due molecole con consumo di ATP (DNA ligasi nella duplicazione del DNA, acetilCoA sintetasi prima del ciclo di Krebs nella respirazione aerobica).
Isomerasi: trasformano una molecola in un suo isomero (fosfoglucoisomerasi: trasforma il glucosio-6P in fruttosio-6P all'inizio della glicolisi).
5) Struttura - L'intera molecola enzimatica è costituita da due parti, una proteica e l'altra non proteica.La parte proteica si chiama apoenzima: è costituita da una o più proteine globulari e ad alto p.m. e determina la specificità di substrato in quanto contiene il sito attivo. Talvolta svolgono la loro attività tal quale.
Normalmente l'apoenzima è unito ad una parte non proteica a basso p.m. detta cofattore, che determina la specificità d'azione e a sua volta può essere di due tipi: a) gruppo prostetico, costituito da uno ione metallico (Fe2+, Zn2+, Mg2+) non separabile dall'apoenzima; b) coenzima, costituito da una molecola organica (NAD+, FAD, ATP, vitamina) separabile dall'apoenzima; mentre gli enzimi a tutt'oggi individuati sono oltre 15.000, i coenzimi sono in numero limitato. Cofattore e apoenzima costituiscono quindi una proteina coniugata detta oloenzima.
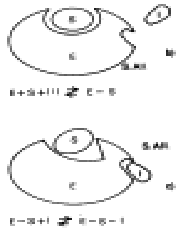
6) Meccanismo d'azione - L'enzima (E) si lega al substrato (S) formando il complesso attivato (E-S), quindi il substrato si trasforma in prodotto (P) e lascia libero l'enzima per una nuova reazione:
E + S E-S E + P
L'enzima è in genere molto più grande della molecola di substrato ed in media con un rapporto 10:1 dei p.m. Si deduce, quindi, che solo una piccola parte dell'enzima è direttamente interessata all'attività catalitica: il sito attivo, costituito in genere da una ripiegatura della superficie dell'apoenzima e la cui forma è determinata dalla struttura terziaria della proteina. In conclusione, la maggior parte degli amminoacidi dell'enzima non entra in contatto con il substrato, ma hanno il ruolo importantissimo di costituire l'impalcatura adatta per favorire il reciproco orientamento enzima-substrato, necessario ad una buona catalisi unitamente alla reciproca vicinanza.
L'inserimento del substrato nel sito attivo può avvenire secondo due modelli:
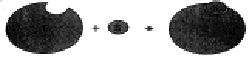 a) modello
chiave-serratura: l'enzima ha una conurazione rigida già perfettamente
complementare a quella del substrato e si ha un riconoscimento reciproco
altamente specifico;
a) modello
chiave-serratura: l'enzima ha una conurazione rigida già perfettamente
complementare a quella del substrato e si ha un riconoscimento reciproco
altamente specifico;
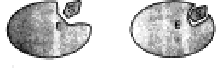 b) modello
dell'adattamento indotto: l'avvicinamento del substrato all'enzima modifica
la struttura del sito attivo, migliorando la reciproca aderenza, e a catalisi
avvenuta l'enzima riacquista la sua forma iniziale. Con questi modelli si
spiega l'elevata specificità degli enzimi, che riconoscono un solo
substrato o un gruppo ristretto di substrati simili, eliminando o riducendo
drasticamente le possibili reazioni collaterali.
b) modello
dell'adattamento indotto: l'avvicinamento del substrato all'enzima modifica
la struttura del sito attivo, migliorando la reciproca aderenza, e a catalisi
avvenuta l'enzima riacquista la sua forma iniziale. Con questi modelli si
spiega l'elevata specificità degli enzimi, che riconoscono un solo
substrato o un gruppo ristretto di substrati simili, eliminando o riducendo
drasticamente le possibili reazioni collaterali.
7) Fattori influenzanti l'attività enzimatica - I più importanti fattori chimico-fisici che influenzano l'attività catalitica sono i seguenti:
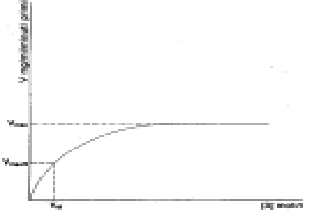
a) Concentrazione del substrato - La velocità della reazione enzimatica aumenta in modo direttamente proporzionale alla concentrazione del substrato, ma poi aumenta in modo meno che proporzionale, fino a raggiungere un valore costante detto velocità massima, indicativa dell'efficienza catalitica e proporzionale al numero di turnover.
b)

 Concentrazione
dell'enzima - La velocità della reazione enzimatica è quasi
direttamente proporzionale alla concentrazione enzimatica.
Concentrazione
dell'enzima - La velocità della reazione enzimatica è quasi
direttamente proporzionale alla concentrazione enzimatica.
c) pH dell'ambiente di reazione - Le variazioni di pH modificano sia la dissociazione dei residui amminoacilici del sito attivo e quindi la sua forma che la dissociazione di gruppi funzionali del substrato e quindi il suo riconoscimento col sito attivo. Come tutte le proteine, anche l'enzima è stabile in un intervallo di pH caratteristico, in genere compreso tra 4 e 9, al di fuori del quale si denatura. In genere la velocità di reazione in funzione del Ph raggiunge un valore massimo per poi diminuire (curva a massimo).
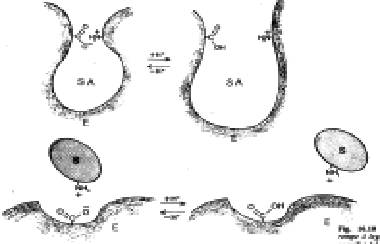
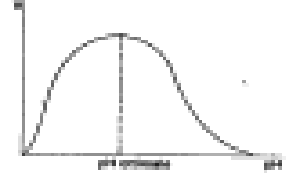
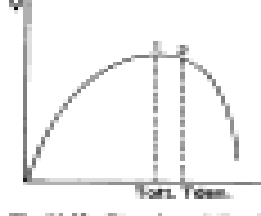
d) Temperatura - Un aumento di temperatura fa crescere esponenzialmente la velocità di reazione, fino ad un certo valore oltre il quale l'apoenzima si denatura compromettendo l'attività enzimatica.
e) Inibitori - Gli inibitori possono agire in maniera irreversibile o reversibile.
Nell'inibizione irreversibile le molecole dell'inibitore (metalli pesanti: Hg2+, Pb2+, Ag2+, Cr2+, . ) si legano al sito attivo formando un composto stabile enzima-inibitore (E-I) incapace di trasformarsi in prodotto e impedendo al substrato di interagire con l'enzima:
![]()
![]() E + I + S E-I + S; E-I -------à E + P
E + I + S E-I + S; E-I -------à E + P
L'inibizione reversibile può essere competitiva o non competitiva.
Nell'inibizione reversibile competitiva le molecole di substrato e di inibitore sono strutturalmente simili e competono per legarsi reversibilmente al sito attivo. Quando prevale la concentrazione del substrato, esso riesce a scacciare l'inibitore dal sito attivo e l'attività catalitica aumenta con la concentrazione del substrato.
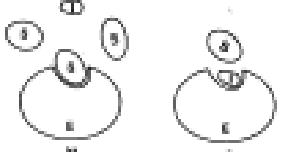
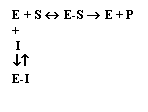

![]()
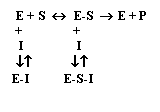
![]()
![]()
![]()
![]()

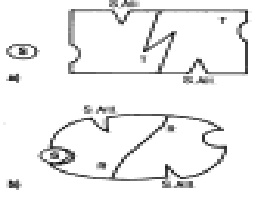
![]() Nell'inibizione reversibile non competitiva l'inibitore si lega
all'enzima o al complesso E-S non nel sito attivo ma in un altro detto sito allosterico: così l'enzima si deforma e anche il
sito attivo, per cui il substrato interagisce più difficilmente.
Nell'inibizione reversibile non competitiva l'inibitore si lega
all'enzima o al complesso E-S non nel sito attivo ma in un altro detto sito allosterico: così l'enzima si deforma e anche il
sito attivo, per cui il substrato interagisce più difficilmente.
f) Attivatori Alcuni ioni metallici agiscono su molti enzimi come attivatori specifici. Ad esempio, gli ioni Mg2+ interagiscono con gli enzimi che hanno come substrato ATP4-, legandosi ad esso sotto forma di (ATP-Mg)2-, migliorando così il reciproco riconoscimento.
Regolazione operata da enzimi - L'insieme delle reazioni chimiche che determinano i processi vitali di una cellula costituiscono i processi metabolici e ciascuna reazione rappresenta una tappa metabolica, la cui velocità dipende da uno specifico enzima. Alcune tappe metaboliche costituiscono veri punti di controllo dell'intero processo, perché sono catalizzate da enzimi forniti di una capacità di risposta agli stimoli molto più rapida di altri. L'enzima regolatore opera in genere su una tappa metabolica irreversibile e fra le prime dell'intero processo metabolico: e1 e2 e

![]()
![]()
![]()
![]() A B C P e1 = enzima regolatore
A B C P e1 = enzima regolatore
tappa met.
processo metabolico
 a) Enzimi allosterici - Questi enzimi sono costituiti da proteine
quaternarie che hanno il sito catalitico e uno o più siti allosterici in cui si inseriscono modulatori positivi o
negativi del sito attivo. Se la regolazione è effettuata da modulatori
diversi dal substrato si parla di enzimi ad effetto eterotropo,
in caso contrario di enzimi ad effetto omotropo.
Secondo il modello di Monod: gli enzimi allosterici sono formati da poche unità simmetriche
e tale simmetria deve sempre mantenersi; ogni subunità
ospita un solo sito attivo; un cambiamento in una subunità
comporta un identico e simultaneo cambiamento delle unità simmetriche.
a) Enzimi allosterici - Questi enzimi sono costituiti da proteine
quaternarie che hanno il sito catalitico e uno o più siti allosterici in cui si inseriscono modulatori positivi o
negativi del sito attivo. Se la regolazione è effettuata da modulatori
diversi dal substrato si parla di enzimi ad effetto eterotropo,
in caso contrario di enzimi ad effetto omotropo.
Secondo il modello di Monod: gli enzimi allosterici sono formati da poche unità simmetriche
e tale simmetria deve sempre mantenersi; ogni subunità
ospita un solo sito attivo; un cambiamento in una subunità
comporta un identico e simultaneo cambiamento delle unità simmetriche.
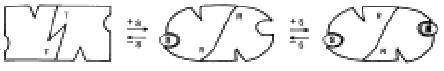 L'entrata del substrato nel sito attivo di una subunità
in forma tesa (T), resa possibile dall'adattamento indotto, la trasforma in una
forma rilasciata (R) e lo stesso cambiamento avviene nella subunità
contigua ad essa associata.
L'entrata del substrato nel sito attivo di una subunità
in forma tesa (T), resa possibile dall'adattamento indotto, la trasforma in una
forma rilasciata (R) e lo stesso cambiamento avviene nella subunità
contigua ad essa associata.
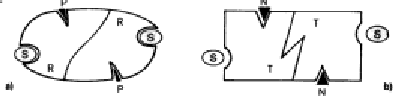 I modulatori
positivi (P), inserendosi nei siti allosterici,
stabilizzano la forma R e favoriscono la penetrazione del substrato. Mentre i modulatori
negativi (N), con lo stesso meccanismo, stabilizzano la forma tesa T
impedendo l'entrata del substrato.
I modulatori
positivi (P), inserendosi nei siti allosterici,
stabilizzano la forma R e favoriscono la penetrazione del substrato. Mentre i modulatori
negativi (N), con lo stesso meccanismo, stabilizzano la forma tesa T
impedendo l'entrata del substrato.
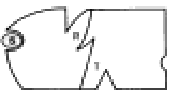
Il modello Koshland, invece, prevede anche l'esistenza di forme ibride intermedie tra la strutture rilasciata e tesa (RT): si avrebbe un passaggio graduale da una struttura all'altra a mano a mano che il substrato viene fissato.
In entrambi i modelli l'entrata di una prima molecola di substrato in una subunità facilita l'entrata delle successive molecole nelle subunità vicine, amplificando l'effetto iniziale sia in senso positivo che negativo. L'esistenza di un equilibrio tra le varie forme spiega come l'uscita del substrato amplifichi l'effetto in senso contrario.
Un importante esempio di regolazione allosterica è l'inibizione retroattiva (feed-back), dove lo stesso prodotto finale (P) di una sequenza metabolica inibisce uno dei primi enzimi (E1) della sequenza stessa:
e1 e e
![]()
![]()
![]()
![]() A B C P e1 = enzima regolatore
A B C P e1 = enzima regolatore
b) Precursori inattivi - Enzimi inizialmente inattivi (chiamati zimogeni o proenzimi), per idrolisi di uno o più legami peptidici, cambiano la propria struttura primaria e diventano biologicamente attivi. Il nome di questi enzimi termina con la desinenza -ogeno (pepsinogeno pepsina, nella digestione delle proteine) o inizia col prefisso pro- (protrombina trombina, nella coagulazione del sangue). La trasformazione da precursore inattivo ad enzima attivo è irreversibile, in quanto la formazione del legame peptidico avviene solo sui ribosomi durante la sintesi proteica.
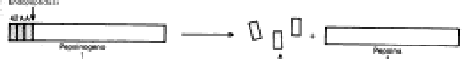
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta