| chimica |
|
LE REAZIONI CHIMICHE
Riferimenti teorici:
Reazione chimica: processo che porta a trasformazioni chimiche della materia formando o rompendo legami chimici.
Elettroni di valenza: elettroni del livello energetico più esterno di un atomo.
Acido: sostanza che aumenta la concentrazione di ioni idrogeno in una soluzione.
Base: sostanza che in una soluzione acquosa fa diminuire la concentrazione di ioni idrogeno.
Reazione esotermica: reazione chimica che libera energia, uguale alla differenza d'energia potenziale tra i reagenti e i prodotti.
Metallo: elemento con bassa energia di ionizzazione, bassa affinità elettronica e bassa elettronegatività. In natura si presenta con un aspetto lucido.
PH: scala di misura dell'acidità o della basicità di una soluzione acquosa.
Miscuglio: insieme di più composti chimici che insieme conservano inalterate le loro singole caratteristiche.
Riferimento teorico relativo al primo esperimento
"Perché avviene una reazione chimica?" La risposta a questo quesito è data dal fatto che gli atomi chimicamente instabili, per raggiungere il completamento del loro ultimo livello energetico, tendono a trasferire o condividere elettroni di valenza. Una reazione chimica è facilitata se immersa in una soluzione acquosa; infatti, se aggiungiamo del cloruro d'argento a del sale da cucina si forma un miscuglio, i cui elementi non reagiscono tra loro; mentre, se diluiamo le due sostanze in acqua, queste, interagendo tra loro danno luogo ad una reazione chimica.
Primo Esperimento
Materiale utilizzato
Provetta
Sostanze utilizzate
AgNO3 --------> Cloruro d'argento
NaCl -------> Cloruro di sodio
Si prende una provetta contenente cloruro di sodio (NaCl) dissolto in acqua e vi si aggiunge del cloruro d'argento (AgNO3), anch'esso dissolto in acqua. Notiamo come il colore della sostanza diventi bianco e opaco. Si è quindi verificata una reazione chimica.


Conclusione
Le due sostanze, immerse separatamente in una soluzione acquosa, si sono dissociate in ioni positivi e negativi.
AgNO3 -----> (Ag)+ + (NO3)- e NaCl -----> (Na)+ + (Cl)-
Mettendo successivamente a contatto le due sostanze notiamo come l'argento si sia legato al cloro e come il sodio si sia legato al nitrato. Ha quindi avuto luogo una reazione di doppio scambio in cui i reagenti iniziali, separati in ioni positivi e negativi, si sono scambiati dando luogo a due nuovi prodotti di reazione.
AgNO3 + NaCl -------> AgCl + NaNO3
Inoltre il cloruro d'argento è precipitato ed il nitrato di sodio, un sale lattiginoso, denota il colore del miscuglio.
Secondo esperimento
Materiale utilizzato:
provetta
Sostanze utilizzate:
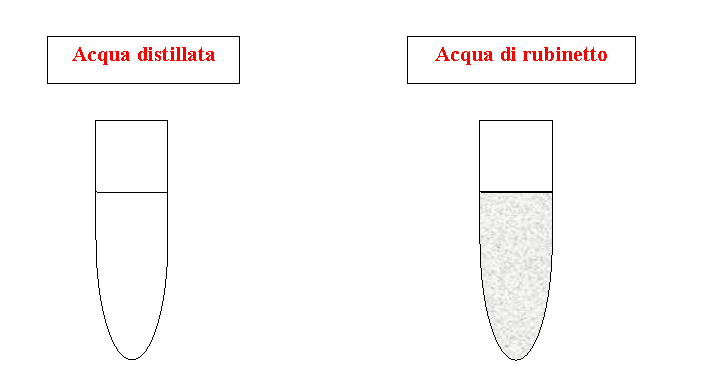
Acqua distillata
Acqua di rubinetto
Nitrato d'argento (AgNO3)
Domanda
Come si riconoscono i due tipi di acqua?
Qual'è l'acqua distillata, ovvero quella priva di ioni?
Esperimento
Si prendono 2 provette, una contenente acqua distillata ed una contenente acqua di rubinetto; si versa in entrambe le provette del cloruro d'argento. Possiamo notare come l'acqua di rubinetto alteri le sue caratteristiche mentre l'acqua distillata conservi il suo aspetto

Conclusione
Il cloruro d'argento, formato da ioni positivi e da ioni negativi, reagisce con gli ioni contenuti nell'acqua di rubinetto dando così luogo ad uno scambio e quindi ad una reazione chimica. Al contrario invece, l'acqua distillata, priva di ioni, non da luogo ad alcun tipo di reazione chimica e mantiene le sue proprietà.
Primo riferimento teorico relativo al terzo esperimento
Se prendiamo una striscia opaca di magnesio e la sottoponiamo ad una raschiatura con la carta vetrata, eliminiamo la polvere ed il metallo riacquista la sua caratteristica originaria di lucentezza. L'opacità prima riscontrata in realtà è l'ossido di magnesio. Il magnesio infatti, a contatto con l'aria, ha perduto due elettroni cedendoli all'ossigeno.
Mg + O ------> MgO


Secondo riferimento teorico relativo al terzo esperimento
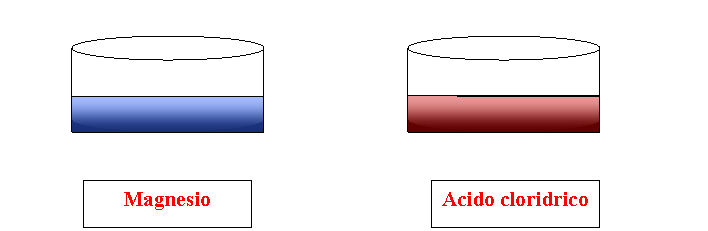
Per prelevare il grado di basicità o acidità di un elemento basta aggiungere qualche goccia dell'indicatore universale di PH. A contatto con questa sostanza il magnesio assume un colore bluastro, tipico delle sostanze basiche. L'acido cloridrico, a contatto con la medesima sostanza diventa di colore rosso scuro, colore caratteristico delle sostanze acide.

Materiale utilizzato:
Provetta
Tappo
Fuscello
Accendino
Sostanze utilizzate:
Magnesio
Acido cloridrico
Terzo Esperimento
Introduciamo in una provetta un miscuglio di magnesio e acido cloridrico a temperatura ambiente. Ciò provoca una turbolenza all'interno del miscuglio e uno sviluppo di gas. Bruciando l'estremità di un fuscello e avvicinandolo alla provetta liberata dell'apposito tappo, si sente un leggero scoppio e la temperatura della provetta aumenta considerevolmente.
Conclusione
E' avvenuta una reazione esotermica provocata dall'idrogeno liberato, chiamato idrogeno tonante proprio per l'effetto prodotto.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta